题目内容
实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,100 ℃左右时升华。图4-19是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试完成下列问题:
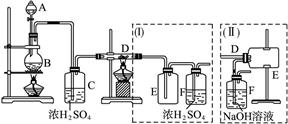
图4-19
(1)B中反应的化学方程式为_______________。
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是_______________。
(5)装置(Ⅱ)的主要缺点是_______________。

图4-19
(1)B中反应的化学方程式为_______________。
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是_______________。
(5)装置(Ⅱ)的主要缺点是_______________。
(1)MnO2+4HCl(浓)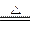 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)在B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D
(3)2Fe+3Cl2====2FeCl3
(4)导管易被产品堵塞;尾气排入空气,造成污染
(5)产品易受潮解在E、F瓶之间连接装有干燥剂的装置
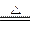 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(2)在B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D
(3)2Fe+3Cl2====2FeCl3
(4)导管易被产品堵塞;尾气排入空气,造成污染
(5)产品易受潮解在E、F瓶之间连接装有干燥剂的装置
由题意“制备FeCl3”可知D管中应是铁粉,A、B装置是Cl2发生装置,C装置是干燥Cl2装置,要使D管中的空气排出,最方便的方法是让产生的Cl2驱赶空气,因此D处先不要加热,待D管中充满Cl2后再加热,以保证Cl2与Fe反应生成FeCl3无杂质。由于氯化铁易升华,因此在D管中的FeCl3易挥发出,而装置Ⅰ中导气管太细,FeCl3易冷凝而在此堵塞,并且多余的Cl2不能被浓H2SO4吸收,排出的尾气会污染空气。在装置Ⅱ中,由于导气管直接插入NaOH溶液中,会有水汽挥发,导致FeCl3潮解。故应在装置Ⅱ的E、F之间加入一干燥装置。

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
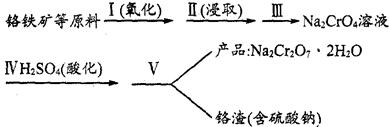
 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。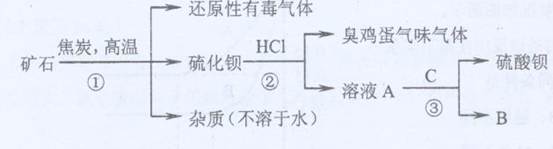 (1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。
(1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。
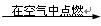 CO
CO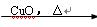 CO2
CO2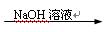 Na2CO3
Na2CO3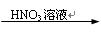 Cu(NO3)2溶液
Cu(NO3)2溶液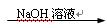 Cu(OH)2
Cu(OH)2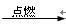 Fe2O3
Fe2O3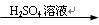 Fe2(SO4)3溶液
Fe2(SO4)3溶液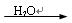 Ca(OH)2溶液
Ca(OH)2溶液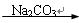 NaOH溶液
NaOH溶液