题目内容
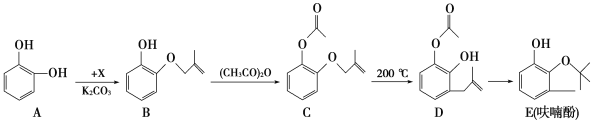
【题目】金属镓是一种广泛用于电子和通信领域的重要金属,其化学性质与铝相似。
(1)工业上提纯镓的方法有很多,其中以电解精炼法为主。具体原理如下:以待提纯的粗镓(含有Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子的氧化性顺序为Zn2+<Ga3+<Fe2+<Cu2+电解精炼镓时阳极泥的成分为________。
②GaO2— 在阴极放电的电极反应式为______。
(2)工业上利用固态Ga与NH3在高温条件下合成固态半导体材料氮化镓(GaN),同时有氢气生成。反应过程中每生成3 mol H2,放出30.8 kJ的热量。
①该反应的热化学方程式为______。
②一定条件下,一定量的Ga与NH3进行上述反应,下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是______(填字母)。
A. 恒温恒压下,混合气体的密度不变
B. 断裂3 mol H—H键,同时断裂2 mol N—H键
C. 恒温恒压下,反应达到平衡时,向反应体系中加入 2 mol H2,NH3的消耗速率等于原平衡时NH3的消耗速率
D. 恒温恒容下, NH3 与H2的物质的量浓度之比为2︰3
【答案】Fe、Cu GaO2-+2H2O+3e-=Ga+4OH- Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g) ΔH= —30.8 kJ·mol-1 AC
2GaN(s)+3H2(g) ΔH= —30.8 kJ·mol-1 AC
【解析】
(1)①离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,则金属还原性顺序为Zn>Ga>Fe>Cu,则阳极上Zn、Ga失电子进入电解质溶液,Fe、Cu以金属单质进入电解质溶液;
②阴极上GaO2-得电子发生还原反应生成Ga;
(2)①反应的方程式为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g),结合生成3mol H2时放出30.8kJ的热量,可知反应热,进而书写热化学方程式;
2GaN(s)+3H2(g),结合生成3mol H2时放出30.8kJ的热量,可知反应热,进而书写热化学方程式;
②可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(1)①离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,则金属还原性顺序为Zn>Ga>Fe>Cu,则阳极上Zn、Ga失电子进入电解质溶液,Fe、Cu以金属单质进入电解质溶液,则阳极泥成分是Fe、Cu;
②阴极上GaO2-得电子发生还原反应生成Ga,电极反应式为GaO2-+3e-+2H2O=Ga+4OH-;
(2)①反应的方程式为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g),结合生成3mol H2时放出30.8kJ的热量,可知热化学方程式为2Ga(s)+2NH3(g)
2GaN(s)+3H2(g),结合生成3mol H2时放出30.8kJ的热量,可知热化学方程式为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.8kJ·mol-1;
2GaN(s)+3H2(g)△H=-30.8kJ·mol-1;
②反应为气体体积增大的反应,
A.恒温恒压下,气体质量不变,体积不变,混合气体的密度不变说明反应达到平衡状态,故A正确;
B.断裂3molH-H键,同时断裂6molN-H键,正逆反应速率相同,断裂3molH-H键,同时断裂2molN-H键,正逆反应速率不同,故B错误;
C.恒温恒压下达平衡,加入2molH2使平衡逆向移动,体积减小压强增大,NH3的消耗速率等于原平衡时NH3的消耗速率,平衡不变,反应达到平衡状态,故C正确;
D.反应为放热反应,升高温度反应速率增大,平衡逆向进行,氢气的生成速率先减小再增大,最后不变,故D错误;
故选AC;

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】请按要求回答下列问题:
(1)纯水在100℃时pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=__mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为__,由水电离出的c(OH-)=___mol·L-1。
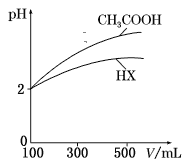
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离常数___(填“大于”“小于”或“等于”)CH3COOH的电离常数。理由是___。
(4)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等pH的a.NaCN溶液、b.Na2CO3溶液和c.CH3COONa溶液,三溶液的浓度由大到小的顺序为___。(用a、b、c表示)
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___。
③25℃时,等浓度的HCN和NaCN混合溶液显___性。(酸、碱、中)
(5)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
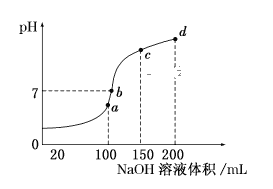
试分析图中a、b、c、d四个点,水的电离程度最大的是__;在b点,溶液中各离子浓度由大到小的排列顺序是__。