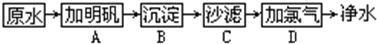
题目内容
17. 某反应由两步反应A═B═C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能).下列有关叙述正确的是( )
某反应由两步反应A═B═C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能).下列有关叙述正确的是( )| A. | 两步反应均为放热反应 | |
| B. | 三种化合物的稳定性顺序:B<A<C | |
| C. | 整个反应的△H=E1-E2 | |
| D. | 加入催化剂不改变反应的焓变,但能提高产率 |
分析 A→B的反应,反应物总能量小于生成物总能量,反应吸热,B→C的反应,反应物的总能量大于生成物总能量,反应为放热反应,结合能量的高低解答该题.
解答 解:A.A→B的反应为吸热反应,B→C的反应为放热反应,故A错误;
B.物质的总能量越低,越稳定,所以三种化合物的稳定性顺序:B<A<C,故B正确;
C.整个反应中△H=(E1-E2)+(E2-E3)-E4=E1-E3-E4,故C错误.
D.加入催化剂,只改变反应的活化能,不改变反应热,只提高反应速率,不改变平衡移动,故D错误;
故选B.
点评 本题考查化学反应与能量变化,题目难度不大,注意把握物质的总能量与反应热的关系,易错点为C,注意把握反应热的计算.

练习册系列答案
相关题目
8.用水稀释0.1mol•L-1氨水,溶液中随着水量的增加而增大的是( )
| A. | $\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})}$ | B. | $\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | ||
| C. | $\frac{c{H}^{+}}{cO{H}^{-}}$ | D. | c(H+)•c(OH-) |
5.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气.下列说法正确的是( )
| A. | 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 | |
| B. | 甲烧杯中的酸过量 | |
| C. | 两烧杯中参加反应的锌等量 | |
| D. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 |
6.在导致反应速率加快的下列改变中,因为增大反应物中活化分子比例而使反应速率增大的是( )
| A. | 增大反应物浓度 | B. | 升高温度 | ||
| C. | 将固体反应物粉碎 | D. | 增大体系压强 |
7.下列说法不正确的是( )
| A. | 磷酸的摩尔质量与NA个硫酸分子的质量在数值上相等 | |
| B. | 6.02×1023个氮分子和6.02×l023个氢分子的质量比等于14:1 | |
| C. | 32g氧气所含的原子数目约为2×6.02×1023 | |
| D. | 标准状况下,0.5NA分氟化氢分子所占体积是11.2L |
 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: