题目内容
【题目】Ⅰ、研究NO2、SO2、CO等大气污染气体的处理具有重要意义
(1)已知:2SO2(g) + O2(g)![]() 2SO3(g) ΔH= —Q1 kJ·mol-1 ;2NO(g) + O2(g)
2SO3(g) ΔH= —Q1 kJ·mol-1 ;2NO(g) + O2(g)![]() 2NO2(g) ΔH= —Q2kJ·mol-1则反应NO2(g) + SO2(g)
2NO2(g) ΔH= —Q2kJ·mol-1则反应NO2(g) + SO2(g)![]() SO3(g) + NO(g) 的ΔH= _________________kJ·mol-1。
SO3(g) + NO(g) 的ΔH= _________________kJ·mol-1。
(2)上述反应达化学平衡的标志是_________________。
A.混合气体的总质量保持不变
B.混合气体的总压强保持不变
C.混合气体的平均相对分子质量保持不变
D.混合气体的颜色保持不变
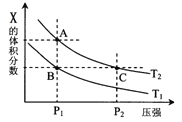
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,该反应ΔH _______0(填“>”或“ <”),理由__________________________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,该反应ΔH _______0(填“>”或“ <”),理由__________________________________。

Ⅱ、甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
①:CH4 ( g ) + H2O ( g ) =CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
②:CO ( g ) + 2H2 ( g ) = CH3OH ( g ) △H=—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_________________________。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。
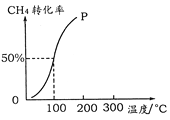
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为_____________。
②100℃时反应I的平衡常数为___________________。
【答案】-(Q1 -Q2)/2 D < 压强相同时,温度升高,CO的平衡转化率减小,平衡逆向移动,逆向吸热,则正向放热 CH4(g)+H2O(g)=CH3OH (g)+H2(g) △H =+77.0 kJ·mol-1 0.003 mol·L-1·min-1 2.25×10-4 mol2·L—2
【解析】
Ⅰ.(1)根据盖斯定律进行计算;
(2)根据可逆反应达到平衡状态的依据进行判断;
(3)从图像上来看,压强相同时,温度升高,CO的平衡转化率减小,平衡逆向移动,逆向吸热,则正向放热;
Ⅱ.(1)根据盖斯定律进行计算;
(2)依据化学平衡三段式列式进行计算。
Ⅰ.(1)已知:①2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-Q1 kJ·mol-1 ,②2NO(g) +O2(g)
2SO3(g) ΔH=-Q1 kJ·mol-1 ,②2NO(g) +O2(g)![]() 2NO2(g) ΔH=-Q2kJ·mol-1,利用盖斯定律将①×1/2-②×1/2得NO2(g)+SO2(g)
2NO2(g) ΔH=-Q2kJ·mol-1,利用盖斯定律将①×1/2-②×1/2得NO2(g)+SO2(g)![]() SO3(g)+NO(g) 的ΔH=-(Q1 -Q2)/2kJ·mol-1,故答案为:-(Q1 -Q2)/2。
SO3(g)+NO(g) 的ΔH=-(Q1 -Q2)/2kJ·mol-1,故答案为:-(Q1 -Q2)/2。
(2)A.反应前后气体总质量始终不变,不能判断是否平衡,故A错误;
B.该反应是一个反应前后气体计量数不变的化学反应,无论该反应是否达到平衡状态,容器中混合气体的总压强保持不变,故B错误;
C.反应前后物质的量不变,气体质量守恒,所以混合气体的平均相对分子质量保持不变,故C错误;
D.当反应达到平衡状态时,各物质的浓度不再变化,所以溶液内混合气体的颜色保持不变,故D正确。
故答案为:D。
(3)从图像上来看,压强相同时,温度升高,CO的平衡转化率减小,平衡逆向移动,逆向吸热,则正向放热,故ΔH<0,故答案为:<;压强相同时,温度升高,CO的平衡转化率减小,平衡逆向移动,逆向吸热,则正向放热。
Ⅱ.(1)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol
依据盖斯定律①+②得到CH4(g)+H2O(g)=CH3OH(g)+H2(g))△H=+77kJ/mol
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g))△H=+77kJ/mol。
(2)①将1.0molCH4和2.0molH2O(g)通入容积固定为100L的反应室,在一定条件下发生反应I:图象分析可知100°C甲烷转化率为50%,依据化学平衡三段式列式
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始量(mol) 1.0 2.0 0 0
变化量(mol) 1.0×50% 0.5 0.5 1.5
平衡量(mol) 0.5 1.5 0.5 1.5
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=1.5mol÷100L÷5min=0.003 mol·L-1·min-1
故答案为:0.003 mol·L-1·min-1。
②100℃时反应I的平衡浓度为c(CH4)=0.005mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常数K=c(CO)c3(H2)c(CH4)c(H2O)=0.005×0.0153/0.005×0.015=2.25×10-4mol2·L-2
故答案为:2.25×10-4mol2·L-2。