题目内容
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为了在实验室合成S2Cl2,某化学研究性小组查阅了有关资料,得到如下信息:
①在110℃-140℃时,将干燥的氯气与硫反应可得到S2Cl2的粗产品.
②有关物质的部分性质如下表:
设计实验装置如下图:
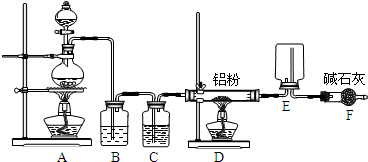
(1)仪器A的名称分别为______.
B中发生反应的离子方程式为______.
C中的试剂名称是______;仪器D的作用是______.
(2)上图中装置不够完善,请你提出改进意见______;
(3)利用改进后的正确装置进行实验,请回答下列问题
①E中反应的化学方程式为______.
②如果在加热E时温度过高,对实验结果的影响是______.
③S2Cl2粗品中可能混有的杂质是SCl2、Cl2、S,为了提高S2Cl2的纯度,关键的操作是控制好温度和______.
①在110℃-140℃时,将干燥的氯气与硫反应可得到S2Cl2的粗产品.
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 44.6 | 略 |
| S2Cl2 | -77 | 137 | S2Cl2、遇水生成HCl、SO2、S且温度过高容易分解(300度以上完全分解) |
| SCl2 | -121 | 59.6(分解) |

(1)仪器A的名称分别为______.
B中发生反应的离子方程式为______.
C中的试剂名称是______;仪器D的作用是______.
(2)上图中装置不够完善,请你提出改进意见______;
(3)利用改进后的正确装置进行实验,请回答下列问题
①E中反应的化学方程式为______.
②如果在加热E时温度过高,对实验结果的影响是______.
③S2Cl2粗品中可能混有的杂质是SCl2、Cl2、S,为了提高S2Cl2的纯度,关键的操作是控制好温度和______.
(1)A、B分别是分液漏斗和蒸馏烧瓶;B中发生反应的离子方程式是浓盐酸与二氧化锰制取氯气的离子方程式:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;氯气制取过程中的产生杂质HCl、H2O,因此先用饱和食盐水除去氯气中的HCl,再用浓硫酸进行干燥即可得纯净干燥的氯气;
故答案:分液漏斗;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;饱和食盐水;除去氯气中少量的水蒸气;
(2)因S2Cl2遇水生成HCl、SO2、S,在G中生成的S2Cl2易与H中扩散过来的水蒸气反应而变质,故应在G和H之间增加干燥装置;
故答案为:在G和H之间增加干燥装置;
(3)①E中反应的化学方程式由信息可得:2S+C12
S2C12
故答案为:2S+C12
S2C12
②由表中信息S2Cl2在300℃以上完全分解,所以加热E时温度过高会导致产率降低,在F中可能有硫析出;
故答案为:因副反应产率降低或S2Cl2因温度过高会分解;
(5)根据信息,温度控制不当,则会生成SCl2,还有未反应的氯气以及蒸发出的硫.所以关键的操作是控制好温度和氯气的气流速度要恰当,应控制浓盐的滴速不要过快;
故答案为:控制浓盐酸的滴速不要过快.
| ||
故答案:分液漏斗;MnO2+4H++2Cl-
| ||
(2)因S2Cl2遇水生成HCl、SO2、S,在G中生成的S2Cl2易与H中扩散过来的水蒸气反应而变质,故应在G和H之间增加干燥装置;
故答案为:在G和H之间增加干燥装置;
(3)①E中反应的化学方程式由信息可得:2S+C12
| ||
故答案为:2S+C12
| ||
②由表中信息S2Cl2在300℃以上完全分解,所以加热E时温度过高会导致产率降低,在F中可能有硫析出;
故答案为:因副反应产率降低或S2Cl2因温度过高会分解;
(5)根据信息,温度控制不当,则会生成SCl2,还有未反应的氯气以及蒸发出的硫.所以关键的操作是控制好温度和氯气的气流速度要恰当,应控制浓盐的滴速不要过快;
故答案为:控制浓盐酸的滴速不要过快.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目