题目内容
将N2.H2混合气体分别充入甲.乙.丙三个容器中进行合成氨反应,经过一段时间后反应速率为:甲 v(H2)= 3mol·(L·min)-1;乙 v(N2)= 2mol·(L·min)-1;丙 v(NH3)= 1mol·(L·min)-1。在这段时间内三个容器中合成氨的反应速率
A.甲 > 乙 > 丙 B.甲 = 乙 = 丙 C.乙 > 甲 > 丙 D.甲 > 丙 > 乙
【答案】
C
【解析】
试题分析:同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比是相应的化学计量数之比先换算成用同一种物质表示,然后才能直接比较速率数值。因此如果都用氢气表示反应速率,则甲、乙、丙分别是3mol·(L·min)-1、6mol·(L·min)-1;、1.5mol·(L·min)-1,所以反应速率最快的是乙,其次是甲,最慢的是丙,答案选C。
考点:考查反应速率的有关计算和应用
点评:本题是基础性试题的考查,难度不大。主要是训练的逻辑思维能力,培养学生的答题能力,调动学生的学习兴趣。

练习册系列答案
相关题目
如图1所示“合成氨”的演示实验(夹持仪器均已省略).在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和NH4Cl饱和溶液反应制取N2,N2和H2混合后通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,则说明产生了氨气.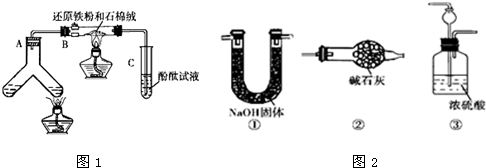
某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生如下反应:
①NaNO2+NH4Cl→NH4NO2+NaCl
②NH4NO2→NH3+HNO2
③2HNO2→N2O3+H2O
④2NH3+N2O3→2N2+3H2O
信息二:查阅资料,不同体积比的N2、H2 混合气体在相同实验条件下合成氨,使酚酞试液变红所需要的时间如下:
据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式: .
(2)铁粉撒在石棉绒上的目的是 .
(3)课外活动小组的同学们认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是 ,请你另设计一个简单的实验验证你的理由 .欲解决这一问题,可以选用图2中的 装置连接在原装置中的 和 之间.
(4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2的体积比为 比较适宜;但该装置还难以实现此目的,原因是 .
(5)实验过程中通入试管C中的气体成分有 .

某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生如下反应:
①NaNO2+NH4Cl→NH4NO2+NaCl
②NH4NO2→NH3+HNO2
③2HNO2→N2O3+H2O
④2NH3+N2O3→2N2+3H2O
信息二:查阅资料,不同体积比的N2、H2 混合气体在相同实验条件下合成氨,使酚酞试液变红所需要的时间如下:
| N2和H2的体积比 | 5:1 | 3:1 | 1:1 | 1:3 | 1:5 |
| 酚酞变红色所需时间/min | 8~9 | 7~8 | 6~7 | 3~4 | 9~10 |
(1)Y形管左侧管中发生反应的离子方程式:
(2)铁粉撒在石棉绒上的目的是
(3)课外活动小组的同学们认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是
(4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2的体积比为
(5)实验过程中通入试管C中的气体成分有
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.