题目内容
半导体工业用石英砂做原料通过三个重要反应生产单质硅
SiO2(s)+2C(s)=Si(s)+2CO(g) △H1=+682.44kJ·mol-1
(石英砂) (粗硅)
Si(s)+2C12(g)=SiCl4(l) △H2=一657.01kJ·mol-1
(粗硅)
SiCl4(l)+2Mg(s)=2MgCl2(s)+Si(s) △H3=一625.63kJ·mol-1
(纯硅)
若生产1.00kg纯硅放出的热量为
SiO2(s)+2C(s)=Si(s)+2CO(g) △H1=+682.44kJ·mol-1
(石英砂) (粗硅)
Si(s)+2C12(g)=SiCl4(l) △H2=一657.01kJ·mol-1
(粗硅)
SiCl4(l)+2Mg(s)=2MgCl2(s)+Si(s) △H3=一625.63kJ·mol-1
(纯硅)
若生产1.00kg纯硅放出的热量为
| A.21.44kJ | B.600.20kJ | C.21435.71kJ | D.1965.10kJ |
C
试题分析:根据关系式1molSiO2 ~ Si(粗硅)~ SiCl4(l)~ 1molSi(纯硅),△H=△H1+△H2+△H3="660.20" kJ·mol-1
,所以若生产1.00kg纯硅放出660.20 kJ·mol-1×(1000÷28)mol=21435.71kJ,C正确

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0

 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 
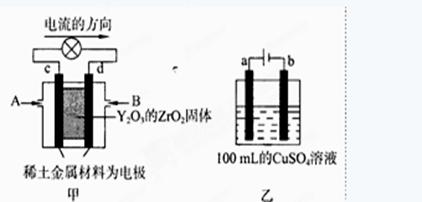
 ,请根据化学反应的有关原理同答下列问题
,请根据化学反应的有关原理同答下列问题



 2NO2(g) △H=+57.20kJ/mol。
2NO2(g) △H=+57.20kJ/mol。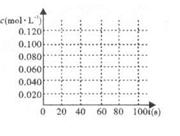
 TiCl4
TiCl4 Ti
Ti  CH3OH(g) ΔH1
CH3OH(g) ΔH1
