题目内容
(12分)(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 ;
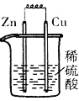
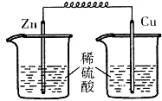
若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极。
(2)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:
2PbSO4 + 2H2O Pb + PbO2 + 2H2SO4
Pb + PbO2 + 2H2SO4
铅蓄电池放电时, (填物质名称)在负极发生反应。放电过程中硫酸浓度由5mol/L下降到 4mol/L,电解液体积为2000mL(反应过程溶液体积变化忽略不计);求放电过程中外电路中转移电子的物质的量为 mol。
(3)有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:
正极:
若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极。
(2)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:
2PbSO4 + 2H2O
 Pb + PbO2 + 2H2SO4
Pb + PbO2 + 2H2SO4铅蓄电池放电时, (填物质名称)在负极发生反应。放电过程中硫酸浓度由5mol/L下降到 4mol/L,电解液体积为2000mL(反应过程溶液体积变化忽略不计);求放电过程中外电路中转移电子的物质的量为 mol。
(3)有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:
正极:
(1)2Fe3++Cu=2Fe2++Cu2+ 
(2)铅 2 (3)CH4+10 OH――8e-=CO32-+7H2O 2O2+8e-+4H2O=8OH-

(2)铅 2 (3)CH4+10 OH――8e-=CO32-+7H2O 2O2+8e-+4H2O=8OH-
(1)铁离子的具有氧化性,能氧化铜,方程式为2Fe3++Cu=2Fe2++Cu2+。根据方程式可知,铜失去电子,所以铜是负极,电解质溶液是氯化铁溶液。所以装置图为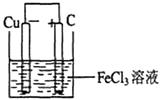 。
。
(2)放电相当于原电池,充电相当于电解池。原电池中负极失去电子,发生氧化反应,所以根据方程式可判断,铅是负极,在负极发生反应。根据方程式可知,每消耗2mol硫酸,反应中就转移2mol电子。消耗硫酸是(5mol/L-4mol/L)×2.0mol=2.0mol,所以转移电子是2mol。
(3)在氢氧燃料电池,氢气在负极通入,氧气在正极通入。由于电解质是氢氧化钾溶液,所以正负极的电极反应式分别是正极:2O2+8e-+4H2O=8OH-、负极:CH4+10 OH――8e-=CO32-+7H2O。
 。
。(2)放电相当于原电池,充电相当于电解池。原电池中负极失去电子,发生氧化反应,所以根据方程式可判断,铅是负极,在负极发生反应。根据方程式可知,每消耗2mol硫酸,反应中就转移2mol电子。消耗硫酸是(5mol/L-4mol/L)×2.0mol=2.0mol,所以转移电子是2mol。
(3)在氢氧燃料电池,氢气在负极通入,氧气在正极通入。由于电解质是氢氧化钾溶液,所以正负极的电极反应式分别是正极:2O2+8e-+4H2O=8OH-、负极:CH4+10 OH――8e-=CO32-+7H2O。

练习册系列答案
相关题目