题目内容
12.某同学利用如图装置对电解质溶液导电性进行实验探究,下列说法中正确的是( )
| A. | 当开关K闭合后,电流计指针发生偏转,证明HCl是电解质 | |
| B. | 闭合开关K,往烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流计指针不发生变化 | |
| C. | 闭合开关K,往溶液中加入CaCO3固体,电流计示数显著增大 | |
| D. | 闭合开关K,往溶液中加入NaOH固体,电流计示数显著增大 |
分析 A.当开关K闭合后,电流计指针发生偏转,说明形成回路;
B.闭合开关K,往烧杯中加入NaCl固体,根据离子浓度变化判断电流计指针变化;
C.闭合开关K,往溶液中加入CaCO3固体,与HCl反应生成氯化钙、水和二氧化碳,根据离子浓度变化判断电流计指针变化;
D.闭合开关K,往溶液中加入NaOH固体,与HCl反应生成氯化钠和水,根据离子浓度变化判断电流计指针变化.
解答 解:A.当开关K闭合后,电流计指针发生偏转,说明形成回路,所以证明HCl是电解质,故A正确;
B.闭合开关K,往烧杯中加入NaCl固体,虽然HCl与NaCl不反应,但离子浓度增大,导电性增强,所以电流计指针发生变化,故B错误;
C.闭合开关K,往溶液中加入CaCO3固体,与HCl反应生成氯化钙、水和二氧化碳,离子浓度基本没变,则电流计示数基本不变化,故C错误;
D.闭合开关K,往溶液中加入NaOH固体,与HCl反应生成氯化钠和水,离子浓度基本没变,则电流计示数基本不变化,故D错误.
故选A.
点评 本题考查电解质的判断及其溶液的导电性,为高频考点,侧重于基本概念的理解和应用的考查,注意相关基础知识的积累,把握离子浓度与导电性成正比,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.能说明苯分子中不存在单、双交替结构,而是所有碳碳键都完全相同的事实是( )
| A. | 间二甲苯只有一种 | B. | 对二甲苯只有一种 | ||
| C. | 邻二甲苯只有一种 | D. | 苯能与液溴反应 |
1.下列说法正确的是( )
| A. | Na2O、Mn2O7、Fe2O3均为碱性氧化物 | |
| B. | 烧碱不是碱、石炭酸不是酸、双氧水不是水 | |
| C. | 电解质在水溶液中的反应都是离子反应 | |
| D. | 单质都有还原性 |
 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.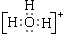 .
.




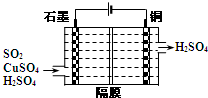 二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.
二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.