题目内容
氢—氧燃料电池是将H2和O2分别通入电池,穿过浸入20%—40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-A.通H2的一极是正极,通O2的一极是负极
B.通O2的一极是正极,通H2的一极是负极
C.工作一段时间后电解质溶液pH增大
D.工作时正极区附近pH减小
B
解析:根据原电池的反应原理可知:化合价升高失去电子的一极为负极,化合价降低、得到电子的一极为正极,可以得出B项正确。由于正负极产生和消耗的OH-一样多,故工作一段时间后电解质溶液pH不变化,工作时正极区附近由于产生了OH-,故pH增大,D项不正确。

练习册系列答案
相关题目
 AgOH+H+
AgOH+H+
 门上的固体材料R可以采用
门上的固体材料R可以采用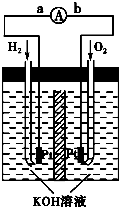 方向为
方向为 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.