题目内容
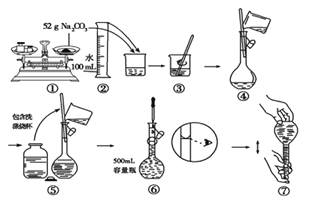
【题目】I、某同学用Na2CO3配制500mL 1.0mol/L Na2CO3溶液的过程如图所示(第⑤步小口瓶中为蒸馏水)。你认为该同学配制溶液的明显错误有(填实验步骤的序号)_______, 所配溶液的浓度(填“低于”、“等于”或“高于”)________ 1.0mol/L。
Ⅱ、一化学兴趣小组,探究从某工业废水(含有大量的FeSO4、较多的Cu2+和少量的Na+)中回收FeSO4制备绿矾(FeSO4·7H2O),同时回收金属铜的方法,以减少污染并交废为宝。以下是他们设计出的回收流程图,回答有关问题。
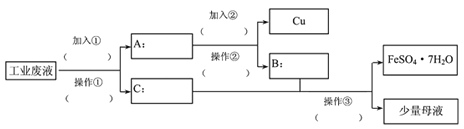
(1)加入的①为(填物质名称)_________,加入②后的离子反应为________。
(2)操作②的名称为_____________。
(3)操作③为蒸发浓缩,降温结晶,过滤,用50%的酒精溶液洗涤绿矾晶体。洗涤FeSO4·7H2O晶体时,用50%的酒精洗涤而未用蒸馏水洗涤的原因是_____________。
(4)母液中含有的离子有(填离子符号): _____________。
【答案】 ①⑥ 低于 铁粉 Fe+2H+=Fe2++H2↑ 过滤 关键点:既能洗除杂质又能减少绿矾的溶解。提高绿矾的产率 填“Na+、Fe2+、SO42-、H+”或“Na+、Fe2+、SO42-”均给2分,只填了一种或两种离子的给1分,有错不给分。
【解析】I、本题考查配制一定物质的量浓度的溶液,用托盘天平称量物品时,应是左物有码,因此①错误,定容时,眼睛应平视液体的凹液面,故⑥错误;配制500mL的Na2CO3溶液,所用m(Na2CO3)=500×10-3×1×106g=53g,定容时俯视读数,所配溶液的体积增大,即浓度偏小,因此所配Na2CO3溶液浓度小于0.1mol·L-1;II、本题考查物质的制备,(1)工业废水中含有Cu2+,根据实验目的,加入的①是过量的铁粉或铁屑,发生Fe+Cu2+=Fe2++Cu,然后过滤,A为过量的铁粉和铜,C为FeSO4溶液,利用铜不与稀硫酸反应,Fe与稀硫酸反应,因此②为稀硫酸,发生Fe+2H+=Fe2++H2↑,然后过滤;(2)根据(1)的分析,操作②是过滤;(3)FeSO4·7H2O溶于水,但不溶于乙醇,因此用乙醇洗涤的目的是减少绿矾的溶解,提高绿矾的产率;(4)根据流程图,母液中含有的离子是H+、Na+、Fe2+、SO42-。