题目内容
高锰酸钾和浓盐酸可以发生下列反应:
2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)该反应的氧化剂是___ ___,还原剂是___ _____。
(2)若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是________ mol。
2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)该反应的氧化剂是___ ___,还原剂是___ _____。
(2)若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是________ mol。
(1)KMnO4 HCl (2)1
试题分析:由方程式2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O可以知道,2KMnO4中的Mn的化合价有+7变为+2,Cl元素的化合价为-1变为0价,所以该反应的氧化剂是KMnO4,还原剂是HCl,该反应转移的电子数为5,所以若消耗0.2 mol氧化剂,即转移的电子数为1mol,所以被氧化的还原剂的物质的量是1mol。
点评:本题考查了一条氧化还原反应方程式的氧化剂和还原剂的判断以及相关的计算,是对氧化还原基础知识的考查,本题比较简单。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
 MnCl2 + C12↑ + 2H2O。下列说法不正确的是( )
MnCl2 + C12↑ + 2H2O。下列说法不正确的是( )  2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
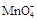 + —— Fe3++ Mn2++
+ —— Fe3++ Mn2++