题目内容
下列叙述中,正确的是( )
| A.pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍 |
| B.1mol/L0.5L的 AlCl3溶液中,阳离子的物质的量大于0.5mol |
| C.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大 |
| D.在由水电离出的c(H+) = 1×10-12mol/L的溶液中,K+、ClO-、SO42-一定能大量共存 |
B
试题分析:A项:PH=-lgc(H+),故.pH=3的盐酸中,其c(H+)是pH=1的盐酸中的10-2倍,故错;C项:依据盐类水解规律“越弱越水解”得NaF溶液的 pH 比 NaCN 溶液小,故错;D项:由水电离出的c(H+) = 1×10-12mol/L的溶液,可能呈酸性也可能呈碱性,ClO-在酸性环境中不能共存,故错。故选B。
点评:本题考查盐类的水解、pH值的计算和离子共存问题,题目难度不大,解答本题时注意把握各项隐含信息,为解答该题的关键,也是易错点

练习册系列答案
相关题目
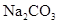 溶液中,下列等量关系成立的是( )
溶液中,下列等量关系成立的是( )