题目内容
氨是一种重要的化工原料,在工农业生产中有很多重要应用I.工业合成氨的流程示意图如图1:回答下列问题:
(1)设备A中含有电加热器、触媒和热交换器,设备A的名称
(2)设备B的名称
(3)设备C的作用是
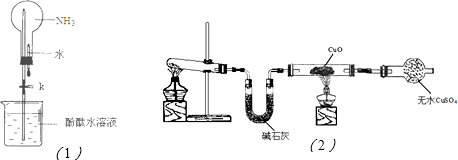
II.制碱工业主要有“氨碱法”和“联合制碱法”两种工艺,氨碱法的工艺如图2所示:
(4)图中的中间产物C是
(5)碳酸化塔中发生反应的化学方程式为
(6)联合制碱法对氨碱法进行了改进,更加符合绿色化学的重要原则,提高了反应的原子利用率.根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=
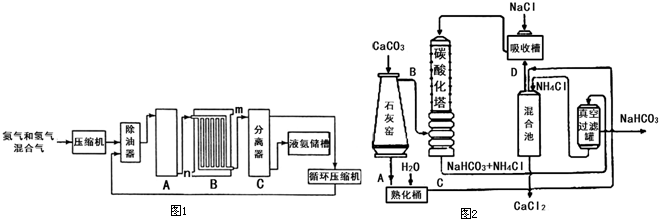
分析:(1)氮气和氢气在合成塔内发生化合反应生成氨气;利用碳或甲烷和水蒸气在高温下反应生成氢气和一氧化碳;
(2)从A中出来的混合气体进入冷却塔冷凝,为了达到最佳冷凝效果,高温气体从冷凝塔上端进入,冷却水从下端进入;
(3)C是分离塔,在分离塔内将液氨和未反应的原理气体分离,原料可循环利用;
(4)碳酸钙分解生成生石灰,生石灰与水反应生成氢氧化钙,氯化铵和氢氧化钙反应生成氯化钙和氨气和水;
(5)二氧化碳、氨气、氯化钠溶液在碳酸化塔中发生反应生成碳酸氢钠和氯化铵;
(6)原子利用率=
×100%,结合联合制碱法方程式解答.
(2)从A中出来的混合气体进入冷却塔冷凝,为了达到最佳冷凝效果,高温气体从冷凝塔上端进入,冷却水从下端进入;
(3)C是分离塔,在分离塔内将液氨和未反应的原理气体分离,原料可循环利用;
(4)碳酸钙分解生成生石灰,生石灰与水反应生成氢氧化钙,氯化铵和氢氧化钙反应生成氯化钙和氨气和水;
(5)二氧化碳、氨气、氯化钠溶液在碳酸化塔中发生反应生成碳酸氢钠和氯化铵;
(6)原子利用率=
| 目标产物总质量 |
| 反应物总质量 |
解答:解:(1)氮气和氢气在合成塔内发生化合反应生成氨气方程式为:N2+3H2
2NH3;碳和水蒸气反应方程式:C+H2O
CO+H2;甲烷和水蒸气反应方程式:CH4+H2O
CO+H2;
故答案为:合成塔;N2+3H2
2NH3;C+H2O
CO+H2;CH4+H2O
CO+H2;
(2)混合气体进入冷却塔冷凝,冷凝水从下口进入上口排除,逆向冷凝效果更好,
故答案为:冷凝器;n;高温气体从冷凝塔上端进入,冷却水从下端进入,逆向冷凝效果更好;
(3)C是分离塔,在分离塔内将液氨和未反应的原理气体分离,
故答案为:在分离塔内将液氨和未反应的原理气体分离;
(4)碳酸钙分解生成生石灰,生石灰与水反应生成氢氧化钙,氯化铵和氢氧化钙反应生成氯化钙和氨气和水,
故答案为:Ca(OH)2;NH3;
(5)二氧化碳、氨气、氯化钠溶液在碳酸化塔中发生反应生成碳酸氢钠和氯化铵方程式为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,
故答案为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;
(6)根据方程式:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl得:原子利用率=
×100%=
×100%,
故答案为:
×100%.
| 催化剂 |
| 高温高压 |
| ||
| ||
故答案为:合成塔;N2+3H2
| 催化剂 |
| 高温高压 |
| ||
| ||
(2)混合气体进入冷却塔冷凝,冷凝水从下口进入上口排除,逆向冷凝效果更好,
故答案为:冷凝器;n;高温气体从冷凝塔上端进入,冷却水从下端进入,逆向冷凝效果更好;
(3)C是分离塔,在分离塔内将液氨和未反应的原理气体分离,
故答案为:在分离塔内将液氨和未反应的原理气体分离;
(4)碳酸钙分解生成生石灰,生石灰与水反应生成氢氧化钙,氯化铵和氢氧化钙反应生成氯化钙和氨气和水,
故答案为:Ca(OH)2;NH3;
(5)二氧化碳、氨气、氯化钠溶液在碳酸化塔中发生反应生成碳酸氢钠和氯化铵方程式为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,
故答案为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;
(6)根据方程式:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl得:原子利用率=
| 目标产物总质量 |
| 反应物总质量 |
| m(Na2CO3)+m(NH4Cl) |
| m(NaCl)+m(NH3)+m(H2O) |
故答案为:
| m(Na2CO3)+m(NH4Cl) |
| m(NaCl)+m(NH3)+m(H2O) |
点评:本题考查“氨碱法”和“联合制碱法”两种工艺的流程,题目难度较大,注意把握反应的原理,注重相关基础知识的积累.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
氨是一种重要的化工原料,氨的合成与应用是当今重要研究内容之一。不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2起始物质的量之比为1∶3)。
|
衡含量(%) 温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
回答下列有关问题:
(1)利用表中数据推断得出合成氨的反应是__________反应(填“放热”、“吸热”或“无热量变化”)。
(2)根据表中数据,在200℃和100MPa时,平衡体系中NH3的物质的量分数最高,而实际工业生产不选用该条件的主要原因是___________________________________。
(3)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“可能增大也可能减小”):
| 反应速率 | 平衡常数K | 氨的体积分数 | |
| 变化情况 |
(4)将1molH2和1molN2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,测得NH3的物质的量为0.3mol,此时若移走0.5molH2和0.5molN2,则反应达到新的平衡时,NH3的物质的量为_____________(选填答案编号)。
A.0.3mol B.0.15mol C.小于0.15mol D.大于0.15mol,小于0.3mol
 ;
; 压强(Mpa)
压强(Mpa) 氨的平
氨的平 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
 mol/(L·min)
mol/(L·min) 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______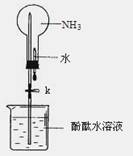

 Cu + Cu2+)。
Cu + Cu2+)。