题目内容
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐 和纯碱的原料,也是一种常用的制冷剂。
(1) 实验室制备氨气的化学反应方程式为_________。
(2) 工业合成氨的反应方程式为:N2(g)+3H2(g) 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
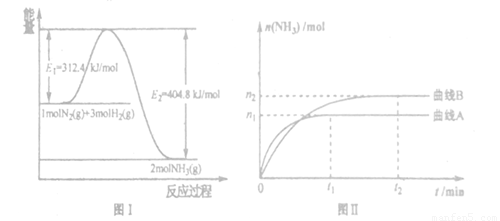
下列说法正确的是_______。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
F.该反应的平銜常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 mol/(L·min)
mol/(L·min)
(3) —定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时 测得容器的压强为起始时的 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(4)已知H2(g)的燃烧热为285.8 kJ/mol,试写出表示NH3(g)燃烧热的热化学反应方程式 _____。以氨气为燃料可以设计制氨燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为_______经測定,该电作过程中每放出1 mol N2实际提供460 kJ的电能,则该燃料电池的实际效率为_____(燃料电池的实标效率是指电池实际提供的电能占燃料电池反应所能释放出的全部能量的百分数)
(1)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O(2分) (2)AEFG (2分)
CaCl2+2NH3↑+2H2O(2分) (2)AEFG (2分)
(3)0.25L2·mol-2(2分,平衡常数不带单位也给分);
a+0.5c=2、b+1.5c=7(2分);2<c<4(2分)
(4)NH3(g)+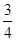 O2(g)=
O2(g)=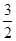 H2O(l)+
H2O(l)+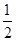 N2(g) △H=-382.5kJ/mol(2分)
N2(g) △H=-382.5kJ/mol(2分)
2NH3-6e-+6OH-=6H2O+N2(2分) 60.1%(1分)
【解析】
试题分析:(1)实验室制备氨气的化学反应方程式为2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)根据图像I可知,反应物的总能量高于生成物的总能量,因此该反应是放热反应,所以ΔH=312.4kJ/mol=404.8kJ/mol=-92.4kJ/mol,A正确;催化剂降低反应的活化能,所以使用催化剂会使E1的数值增大,B不正确;为了提高转化率,工业生产中反应的浓度并不是越低越好,C不正确;根据图像Ⅱ可知,曲线A首先达到平衡状态,这说明曲线A的反应速率快。但平衡时曲线A表示的氨气物质的量低,由于正方应是体积减小的放热的可逆反应,所以曲线Ⅱ中表示的条件是升高温度,所以选项D不正确,E正确;升高温度平衡向逆反应方向移动,所以平衡常数减小,因此选项F正确。根据图像Ⅱ可知,反应进行到t1时,可逆反应达到平衡状态,此时生成氨气的物质的量是n1mol,所以消耗氮气的物质的量是2n1mol,所以在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为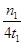 mol/(L·min),G正确,答案选AEFG。
mol/(L·min),G正确,答案选AEFG。
(3)
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始浓度(mol/L) 1 3.5 0
转化浓度(mol/L) x 3x 2x
平衡浓度(mol/L) 1-x 3.5-3x 2x
达到平衡时 测得容器的压强为起始时的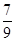 倍
倍
所以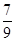 ×4.5=1-x+3.5-3x+2x
×4.5=1-x+3.5-3x+2x
解得x=0.5
所以该温度下可逆反应的平衡常数K=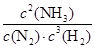 =
=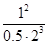 =0.25L2·mol-2
=0.25L2·mol-2
对于恒温恒容下对于反应前后气体体积发生变化的反应来说(即△n≠0的体系):等效转化后,对应各物质起始投料的物质的量与原平衡起始态相同即可,据此可知欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为a+0.5c=2、b+1.5c=7。由于平衡时氨气的物质的量是2mol,所以要欲使反应在起始时向逆反应方向进行,c的取值范围是c>2。当起始时反应物的物质的量为0时,氨气的物质的量最大,所以根据a+0.5c=2、b+1.5c=7可知,c=4或4.7,因此c的取值范围是2<c<4。
(3)H2(g)的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式是H2(g)+0.5O2(g)=H2O(l)
△H=-285.8 kJ/mol…①,所以根据N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol…②可知,②÷2-①×
2NH3(g) △H=-92.4kJ/mol…②可知,②÷2-①×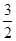 即得到热化学方程式NH3(g)+
即得到热化学方程式NH3(g)+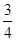 O2(g)=
O2(g)=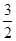 H2O(l)+
H2O(l)+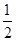 N2(g) △H=-382.5kJ/mol。原电池负极失去电子,发生氧化反应,正极得到电子,发生还原反应。所以在该燃料电池中氨气失去电子,在负极通入,其电极反应式是2NH3-6e-+6OH-=6H2O+N2。根热化学方程式可知,每生成1 mol N2放出765kJ能量,而实际提供460 kJ的电能,所以该燃料电池的实际效率为
N2(g) △H=-382.5kJ/mol。原电池负极失去电子,发生氧化反应,正极得到电子,发生还原反应。所以在该燃料电池中氨气失去电子,在负极通入,其电极反应式是2NH3-6e-+6OH-=6H2O+N2。根热化学方程式可知,每生成1 mol N2放出765kJ能量,而实际提供460 kJ的电能,所以该燃料电池的实际效率为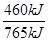 ×100%=60.1%。
×100%=60.1%。
考点:考查氨气制备、反应热、反应速率、外界条件对平衡状态的影响、盖斯定律的应用、平衡常数的计算以及原电池原理的有关应用等

 智能训练练测考系列答案
智能训练练测考系列答案(1)传统哈伯法合成氨工艺中,N2+3H2
 2NH3△H<0
2NH3△H<0①该反应的平衡常数K的表达式为:K=______.升高温度,K值______(填“增大”、“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3 )
| 压强(Mpa) 氨的平衡含(%) 温度(摄氏度) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
③下列关于合成氨说法正确是______
A、使用催化剂可以提高NH3的产率
B、寻找常温下的合适催化剂是未来研究的方向
C、由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O.写出负极电极反应式______,你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),其原因是______.