题目内容
6.高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.(1)请完成FeO42-与水反应的离子方程式:4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用是杀菌消毒和吸附悬浮物.
(2)将适量K2FeO4配制成c(FeO42-)=1.0mmol•L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ.第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是温度升高,反应速率加快,平衡向正反应方向移动;发生反应的△H>0.
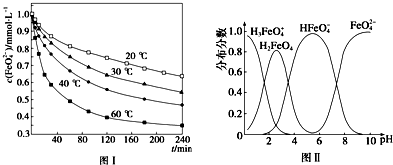
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是B(填字母).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-═HFeO4-+H2O
(4)H2FeO4═H++HFeO4-的电离平衡常数表达式为K=$\frac{c({H}^{+})c(Fe{{O}_{4}}^{2-})}{c(HFe{{O}_{4}}^{-})}$.
分析 (1)根据元素守恒和化合价的变化分析;高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
(2)温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小;温度越高FeO42-浓度越小,正向反应是吸热反应;
(3)根据图象的内容来分析图象所描述的意义;
(4)平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比.
解答 解:(1)根据元素守恒可知未知产物应含氧元素,反应中Fe元素化合价降低,则氧元素化合价升高,所以产物为氧气,根据原子守恒可知为3O2;高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:3O2↑;杀菌消毒、吸附悬浮物;
(2)由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应;
故答案为:温度升高,反应速率加快,平衡向正反应方向移动;>;
(3)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B.根据图片知,改变溶液的pH,当溶液由pH=2变化至pH=10的过程中,HFeO4-的分布分数先增大后减小,故正确;
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故C错误;
故答案为:B;
(4)HFeO4-?H++FeO42-的电离平衡常数表达式为K=$\frac{c({H}^{+})c(Fe{{O}_{4}}^{2-})}{c(HFe{{O}_{4}}^{-})}$,故答案为:$\frac{c({H}^{+})c(Fe{{O}_{4}}^{2-})}{c(HFe{{O}_{4}}^{-})}$.
点评 本题考查了缺项方程式的配平、电离平衡、温度对平衡的影响等知识点,题目难度中等,注意对图象的分析是解题的关键.

 阅读快车系列答案
阅读快车系列答案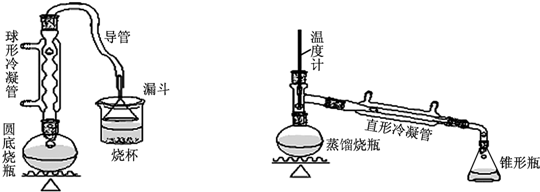
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是既可以吸收充分,又可以防止倒吸.
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是ab.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3).请评价该同学设计的鉴定方案是否合理?为什么?
(4)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如表:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
| A. | 无水CuSO4 | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |

| A. | 向C溶液中滴加KSCN溶液,溶液变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液A |
| A. | a=$\frac{PM}{2000ρ}$ | B. | P=$\frac{200ρa}{M}$ | C. | P$\frac{1000ρ×a%}{M}$×2 | D. | V×ρ×a%=$\frac{PMV}{1000}$ |
 研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.
研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题. .
. .
.