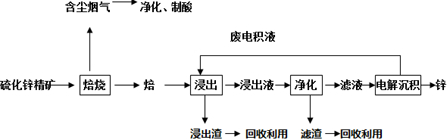
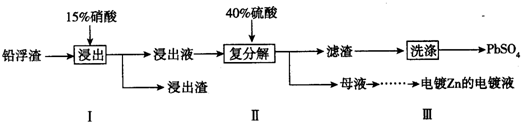
题目内容
16.物质 R2CO3 的饱和溶液 V mL,密度为 ρ g•cm-3,c(R+)=P mol•L-1,溶质的质量分数为 a%,溶质的式量为 M.则下列表达式正确的是( )| A. | a=$\frac{PM}{2000ρ}$ | B. | P=$\frac{200ρa}{M}$ | C. | P$\frac{1000ρ×a%}{M}$×2 | D. | V×ρ×a%=$\frac{PMV}{1000}$ |
分析 A.根据c=$\frac{1000ρω}{M}$计算出该溶液的质量分数;
B.根据A的分析得出P的表达式;
C.根据c(R2CO3 )=$\frac{1}{2}$c(R+)=$\frac{1}{2}$P mol•L-1=$\frac{1000ρ•a%}{M}$分析;
D.V×ρ×a%为溶液中含有溶质的质量,结合m=nM计算.
解答 解:A.该溶液的浓度为:c(R2CO3 )=$\frac{1}{2}$c(R+)=$\frac{1}{2}$P mol•L-1=$\frac{1000ρ•a%}{M}$,则a=$\frac{PM}{20ρ}$,故A错误;
B.根据A可知a=$\frac{PM}{20ρ}$,则P=$\frac{20ρa}{M}$,故B错误;
C.c(R2CO3 )=$\frac{1}{2}$c(R+)=$\frac{1}{2}$P mol•L-1=$\frac{1000ρ•a%}{M}$,则P=$\frac{1000ρ×a%}{M}$×2,故C正确;
D.该溶液中含有溶质的质量为:m=V×ρ×a%=nM=$\frac{1}{2}$P mol•L-1×V×10-3L×Mg/mol=$\frac{PMV}{2000}$,故D错误;
故选C.
点评 本题考查了物质的量浓度与溶质质量分数的关系及计算,题目难度中等,明确物质的量浓度、溶质质量分数的概念及转化关系为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列说法中正确的是( )
| A. | 常温下0.4 mol/L HB溶液和 0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 等浓度的下列稀溶液:①硫酸氢钠 ②乙酸钠 ③醋酸 ④碳酸氢钠 ⑤硝酸钠 ⑥苯酚钠,它们的pH由小到大排列为:③⑤①④②⑥ | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 在25℃时,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
8.向X的溶液中,加入Y试剂,产生的沉淀示意图如图所示情形的是(注意线段的斜率)( )
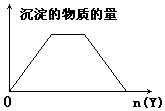

| A. | 向NaOH和Ca(OH)2的混合液中通入CO2 | |
| B. | 向HCl和AlCl3的混合液中滴加NaOH | |
| C. | 向NH4Cl和AlCl3的混合液中滴加NaOH | |
| D. | 向含NaOH的NaAlO2溶液中滴加盐酸 |
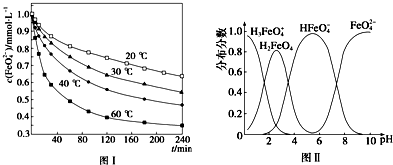

 .
.