题目内容
【题目】下列实验装置或操作设计正确,且能达到实验目的的是
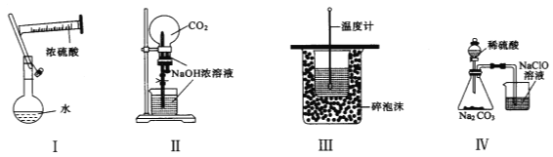
A.实验Ⅰ:配制一定物质的量浓度的稀硫酸
B.实验Ⅱ:用二氧化碳做喷泉实验
C.实验Ⅲ:进行中和热的测定
D.实验Ⅳ:验证酸性强弱H2SO4>H2CO3>HClO
【答案】B
【解析】
A. 一定浓度稀硫酸的配制,应该先在烧杯中稀释浓硫酸,冷却后再转移到容量瓶内,故A错误;
B. 打开弹簧夹,挤压胶头滴管,二氧化碳与氢氧化钠溶液反应,二氧化碳体积可持续减少,能形成较大的压强差,可以产生喷泉,故B正确;
C. 缺少环形玻璃搅拌棒,否则导致混合溶液温度不均匀,测定结果不准确,故C错误;
D. 二氧化碳通入NaClO溶液中会生成HClO,但是该反应没有明显现象,无法通过该实验看出是否有HClO生成,故D错误;
答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060