题目内容
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式____________________________。
(3)氢氧化铁胶体中微粒直径的范围是______,证明有氢氧化铁胶体生成的实验操作是______________。
(4)取少量制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是_________,这种现象称为胶体的________。
(5)氢氧化铁胶体稳定存在的主要原因是________(填字母,下同)。
A.胶体微粒直径小于1 nm B.胶体微粒带正电荷
C.胶体微粒做布朗运动 D.胶体微粒能透过滤纸
(6)Fe(OH)3胶体区别于FeCl3溶液的最本质特征是________。
A.Fe(OH)3胶体微粒的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔现象
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
【答案】B FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 1~100 nm(或10-9~10-7m) 让一束光线通过制得的物质,从侧面观察到一条光亮的“通路”,证明有氢氧化铁胶体生成 产生红褐色沉淀 聚沉 B A
Fe(OH)3(胶体)+3HCl 1~100 nm(或10-9~10-7m) 让一束光线通过制得的物质,从侧面观察到一条光亮的“通路”,证明有氢氧化铁胶体生成 产生红褐色沉淀 聚沉 B A
【解析】
(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液;
(2)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
(3)胶体具有丁达尔性质,是区别其它分散系的独特性质;
(4)胶体粒子带有电荷,加入电解质溶液消除粒子所带电荷,会使胶粒之间的排斥力减小,使胶体聚沉;
(5)胶粒带正电荷,相互排斥,而不易产生较大粒子而聚沉;
(6)胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同。
(1)利用FeCl3的水解制备Fe(OH)3胶体,制备Fe(OH)3胶体应将饱和FeCl3溶液滴入沸水中,答案选B。
(2)制备氢氧化铁胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
(3)氢氧化铁胶体中微粒直径的范围是1~100nm(或10-9~10-7m);证明有胶体存在利用丁达尔效应。操作过程为:让一束光线通过制得的物质,从侧面观察到一条光亮的“通路”,证明有氢氧化铁胶体生成。
(4)(NH4)2SO4溶液属于电解质溶液,(NH4)2SO4溶液加到Fe(OH)3胶体中,Fe(OH)3胶体发生聚沉,可以观察到产生红褐色沉淀。这种现象称为胶体的聚沉。
(5)Fe(OH)3胶体能稳定存在的原因是:Fe(OH)3胶体粒子吸附阳离子而带有正电荷,同种电荷的粒子之间相互排斥阻碍了胶体粒子变大,使它们不易聚集,能稳定存在;此外胶体粒子所作的布朗运动也使得它们不容易聚集成质量较大的颗粒而沉降下来;主要原因是胶粒带正电荷,答案选B。
(6)A、Fe(OH)3胶体粒子的直径在1~100nm之间,FeCl3溶液中溶质粒子直径小于1nm,是两者的本质区别;
B、Fe(OH)3胶体具有丁达尔效应,FeCl3溶液没有丁达尔效应,不是两者的本质区别;
C、FeCl3溶液和Fe(OH)3胶体都是均一的分散系;
D、FeCl3溶液、Fe(OH)3胶体的分散质粒子都能透过滤纸;
答案选A。

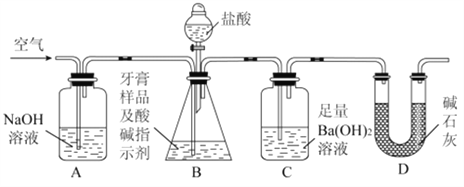
【题目】下图是实验室制备氯气并进行一系列相关实验的装置。

(1)装置B作用之一是为了除去氯气中的杂质HCl,盛装的液体试剂为__________;
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入的物质正确的是__________ (填字母编号) ;
编号 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(3)D中发生反应的化学方程式是_________________________________。将装置D中的溶液加入装置E中,溶液分为两层,上层呈紫红色,要分离出紫红色溶液,需使用的玻璃仪器是玻璃棒、烧杯和_____________;
(4)装置F中反应的化学方程式为_____________;
(5)如果本实验使用的浓盐酸质量分数为36.5%、密度为1.15 g/cm3,此盐酸的物质的量浓度为_____mol·L-1,若用250 mL水配制,则应溶解标况下HCl气体约为_____________L(结果保留3位有效数字)。