题目内容
V ml溶液中含有Fe3+ m g,则溶液中SO42-的物质的量浓度为
mol/L
mol/L;448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为
标况下,将1g氦气、11g二氧化碳和4g氧气混合,该混合气体的体积约为
| 3000m |
| 112V |
| 3000m |
| 112V |
64
64
g/mol;标况下,将1g氦气、11g二氧化碳和4g氧气混合,该混合气体的体积约为
14
14
L.分析:根据n=
=
,结合物质的组成计算.
| m |
| M |
| V |
| Vm |
解答:解:n(Fe3+)=
mol,
n(SO42-)=
×n(Fe3+)=
mol,
c(SO42-)=
=
mol/L;
根据n=
=
,
M=
=
=64g/mol;
标况下,将1g氦气的物质的量为:n(He)=
mol,
11g二氧化碳的物质的量为:n(CO2)=
=
mol,
4g氧气的物质的量为:n(O2)=
=
mol,
所以气体的总物质的量为:(
+
+
)mol=0.625mol,
气体的体积为:0.625mol×22.4L/mol=14L,
故答案为:
mol/L;64;14.
| m |
| 56 |
n(SO42-)=
| 3 |
| 2 |
| 3m |
| 112 |
c(SO42-)=
| ||
| V×10-3L |
| 3000m |
| 112V |
根据n=
| m |
| M |
| V |
| Vm |
M=
| m?Vm |
| V |
| 1.28g×22.4L/mol |
| 0.448L |
标况下,将1g氦气的物质的量为:n(He)=
| 1 |
| 4 |
11g二氧化碳的物质的量为:n(CO2)=
| 11g |
| 44g/mol |
| 1 |
| 4 |
4g氧气的物质的量为:n(O2)=
| 4g |
| 32g/mol |
| 1 |
| 8 |
所以气体的总物质的量为:(
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 8 |
气体的体积为:0.625mol×22.4L/mol=14L,
故答案为:
| 3000m |
| 112V |
点评:本题考查物质的量的计算,题目难度不大,注意有关计算公式的运用.

练习册系列答案
相关题目
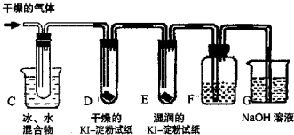
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验Ⅰ反应产物的定性探究
按如图装置(固定装置已略去)进行实验
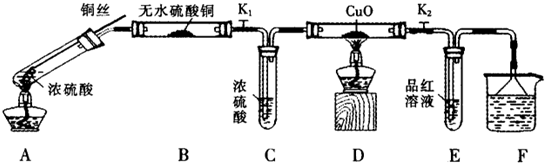
(1)F烧杯中的溶液是 .
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 .
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 .
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 .
(5)为说明浓硫酸中的水会否影响B装置现象的判断,还须进行一次实验.实验方案为 .
实验Ⅱ反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种.
仅由上述资料可得出的正确结论是 .
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol?L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol?L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL.若反应消耗铜的质量为ag,则硫酸铜的产率为 .
(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
实验Ⅰ反应产物的定性探究
按如图装置(固定装置已略去)进行实验

(1)F烧杯中的溶液是
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
(5)为说明浓硫酸中的水会否影响B装置现象的判断,还须进行一次实验.实验方案为
实验Ⅱ反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:
| 硫酸/mol?L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
仅由上述资料可得出的正确结论是
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol?L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol?L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL.若反应消耗铜的质量为ag,则硫酸铜的产率为
(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
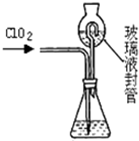 Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是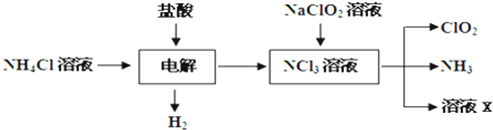


 F.x=
F.x=