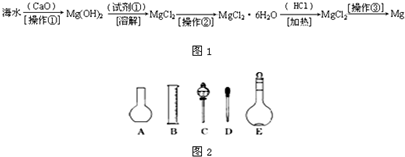
题目内容
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 (可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:

(1)写出电解时发生反应的化学方程式: ;
(2)除去ClO2中的NH3可选用的试剂是 ;(填序号)
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL足量硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收(假设吸收完
全);将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定
(I2+2S2O32-=2I- +S4O62-),共用去V mL硫代硫酸钠溶液。

① 装置中玻璃液封管的作用是 ;
② 请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③ 测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
(14分)Ⅰ.CE(2分)Ⅱ.(1)NH4Cl+2HCl 3H2↑+NCl3(3分)(2)C(2分)
3H2↑+NCl3(3分)(2)C(2分)
(3)①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等(2分)
②2ClO2+10I-+8H+=4H2O+5I2+2Cl-(3分) ③1.35cv×10-2g(2分)
【解析】
试题分析:Ⅰ. A.用pH试纸测定Na2CO3溶液的pH,可用玻璃棒蘸取溶液,滴在玻璃片上的pH试纸上观察;B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl,用到过滤和蒸发操作,分别用玻璃棒进行引流和搅拌;C.制备Fe(OH)2白色沉淀,无需使用玻璃棒;D.配制一定物质的量浓度的氯化钠溶液,需要溶解和转移,需要玻璃棒的搅拌和引流;E.取某溶液做焰色反应实验,用铂丝蘸取待测液,无需使用玻璃棒;F.进行浓硫酸的脱水性实验,应用玻璃棒不断搅拌;G.促使过饱和的硝酸钾溶液析出晶体,过滤需要玻璃棒引流,所以不需要使用玻璃棒进行操作的是CE。
Ⅱ.(1)由工艺流程转化关系可知,电解氯化铵与盐酸混合溶液,生成NCl3与H2,所以该反应的化学方程式为NH4Cl+2HCl 3H2↑+NCl3。
3H2↑+NCl3。
(2)A、ClO2易溶于水,不能利用饱和食盐水吸收氨气,故A错误;B、氨气是碱性气体,碱石灰不能吸收氨气,故B错误;C、浓硫酸可以吸收氨气,且不影响ClO2,故C正确;D、ClO2易溶于水,不能利用水吸收氨气,故D错误,因此答案选C。
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=4H2O+5I2+2Cl-。在反应中ClO2是过量的,所以装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等。
②根据①中分析可知,二氧化氯气体与碘化钾溶液反应的离子方程式2ClO2+10I-+8H+=4H2O+5I2+2Cl-。
③VmLNa2S2O3溶液含有Na2S2O3物质的量为V•10-3L×cmol/L=c•V•10-3mol,则:
根据关系式可知:2ClO2~5I2~10Na2S2O3
2 10
n(ClO2) c•V•10-3mol
所以n(ClO2)=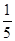 ×c•V•10-3mol
×c•V•10-3mol
因此m(ClO2)=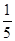 ×c•V•10-3mol×67.5g/mol=1.35cv×10-2g。
×c•V•10-3mol×67.5g/mol=1.35cv×10-2g。
考点:考查玻璃棒作用;制备实验方案的设计;电解原理;氯、溴、碘及其化合物的综合应用等

| A、用pH试纸测定Na2CO3溶液的pH | B、从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl | C、用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2 | D、用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验 |