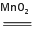题目内容
实验室可用MnO2和KClO3混合加热的方法制取氧气:2KClO3
| ||
| △ |
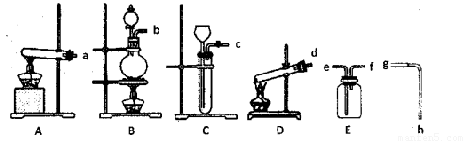
现有下列仪器或装置:
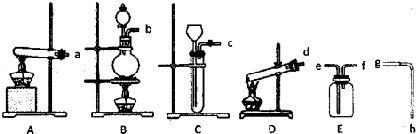
(1)A-D装置中,用作KClO3为原料制氧气的反应装置是
(2)排水法收集氧气,接口顺序是:氧气出口→
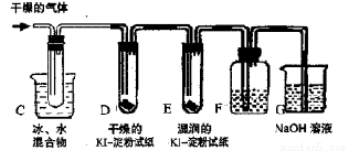
Ⅱ. KClO3分解时尚有副反应,导致收集到的气体有异味.据推测,副产物可能是O3、Cl2、ClO2中的一种或几种.资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2.为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入下图装置进行实验:
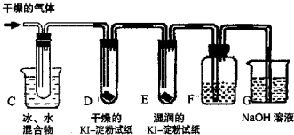
(3)若要确认副产物中含Cl2,F中应盛放
(4)确定副产物中含有ClO2的现象是
(5)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有O3的结论?
答:
Ⅲ.ClO2是饮用水消毒剂.用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2-.为测定此饮用水中两者成分,进行如下实验:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I-═I2+2ClO2-,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后叉产生b mol I2.
(6)饮用水中c(ClO2-)=
分析:(1)依据反应物状态和反应条件选择气体发生装置,反应是固体+固体
气体,选择大试管加热生成;
(2)氧气是难溶于水的比空气重的气体,用排水法收集导气管短进长出;
(3)确认副产物中含Cl2,利用氯气和水反应生成盐酸和次氯酸,加入硝酸银溶液生成白色沉淀证明含有氯气;
(4)ClO2的沸点11℃,冷却变化为液态,确定副产物中含有ClO2的现象是装置C中有液体生成;
(5)实验时若D中无现象,E中试纸变蓝,说明气体中含有氧化性的气体,O3、氯气都具有强氧化性;
(6)依据化学方程式计算ClO2反应生成ClO2-,原水样中的ClO2-和ClO2反应生成ClO2-,调节PH和碘离子反应,依据反应ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后产生b mol I2.计算得到ClO2-,物质的量共为0.5bmol,减去第一个反应生成的ClO2-,得到原水样中含有的ClO2-,得到饮用水中ClO2-的浓度;
| ||
(2)氧气是难溶于水的比空气重的气体,用排水法收集导气管短进长出;
(3)确认副产物中含Cl2,利用氯气和水反应生成盐酸和次氯酸,加入硝酸银溶液生成白色沉淀证明含有氯气;
(4)ClO2的沸点11℃,冷却变化为液态,确定副产物中含有ClO2的现象是装置C中有液体生成;
(5)实验时若D中无现象,E中试纸变蓝,说明气体中含有氧化性的气体,O3、氯气都具有强氧化性;
(6)依据化学方程式计算ClO2反应生成ClO2-,原水样中的ClO2-和ClO2反应生成ClO2-,调节PH和碘离子反应,依据反应ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后产生b mol I2.计算得到ClO2-,物质的量共为0.5bmol,减去第一个反应生成的ClO2-,得到原水样中含有的ClO2-,得到饮用水中ClO2-的浓度;
解答:解:(1)用作KClO3为原料制氧气的反应是固体+固体
气体,选择大试管加热生成,试管口略向下倾斜,应选择装置A;
故答案为:A;
(2)氧气是难溶于水的比空气重的气体,用排水法收集导气管短进长出,接口顺序是:氧气出口fegh烧杯;
故答案为:f、e;
(3)利用氯气和水反应生成盐酸和次氯酸,加入硝酸银溶液生成白色沉淀证明含有氯气,若要确认副产物中含Cl2,F中应盛放硝酸银溶液;
故答案为:AgNO3溶液;
(4)ClO2的沸点11℃,冷却会变化为液态,所以确定副产物中含有ClO2的现象是C装置试管中有液体生成;
故答案为:C装置试管中有液体生成;
(5)实验时若D中无现象,E中试纸变蓝,说明气体中含有氧化性的气体,O3、氯气都具有强氧化性,所以上述现象不能说明副产物含有O3的结论,氯气也可以银行碘化钾生成碘单质;
故答案为:不能,Cl2也可以氧化KI产生I2;
(6)准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I-═I2+2ClO2-,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后叉产生b mol I2;原水样中的ClO2-和ClO2反应生成ClO2-,调节PH后,ClO2-和碘离子反应,依据反应ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后产生b mol I2.计算得到ClO2-,物质的量共为0.5bmol,减去第一个反应生成的ClO2-物质的量,依据化学方程式2ClO2+2I-═I2+2ClO2-,计算得到为2amol,得到原水样中含有的ClO2-物质的量=(0.5b-2a)mol,得到饮用水中ClO2-的浓度=
=
mol/L;
故答案为:
;
| ||
故答案为:A;
(2)氧气是难溶于水的比空气重的气体,用排水法收集导气管短进长出,接口顺序是:氧气出口fegh烧杯;
故答案为:f、e;
(3)利用氯气和水反应生成盐酸和次氯酸,加入硝酸银溶液生成白色沉淀证明含有氯气,若要确认副产物中含Cl2,F中应盛放硝酸银溶液;
故答案为:AgNO3溶液;
(4)ClO2的沸点11℃,冷却会变化为液态,所以确定副产物中含有ClO2的现象是C装置试管中有液体生成;
故答案为:C装置试管中有液体生成;
(5)实验时若D中无现象,E中试纸变蓝,说明气体中含有氧化性的气体,O3、氯气都具有强氧化性,所以上述现象不能说明副产物含有O3的结论,氯气也可以银行碘化钾生成碘单质;
故答案为:不能,Cl2也可以氧化KI产生I2;
(6)准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I-═I2+2ClO2-,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后叉产生b mol I2;原水样中的ClO2-和ClO2反应生成ClO2-,调节PH后,ClO2-和碘离子反应,依据反应ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后产生b mol I2.计算得到ClO2-,物质的量共为0.5bmol,减去第一个反应生成的ClO2-物质的量,依据化学方程式2ClO2+2I-═I2+2ClO2-,计算得到为2amol,得到原水样中含有的ClO2-物质的量=(0.5b-2a)mol,得到饮用水中ClO2-的浓度=
| (0.5b-2a)mol |
| V×10-3L |
| 1000×(0.5b-2a) |
| V |
故答案为:
| 1000×(0.5b-2a) |
| V |
点评:本题考查了气体制备实验过程和装置分析判断,反应过程中的现象和题干信息利用是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目