题目内容
【题目】长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定某无水亚硫酸钠试剂的质量分数,设计了如图所示实验装置:
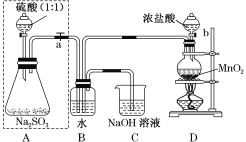
请回答下面的问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性?________。
(2)D装置中反应的化学方程式为_________。B装置中反应的离子方程式为__________。
(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀b g,原样品中Na2SO3的质量分数为______。
(4)C装置中反应的离子方程式为_____________。
【答案】关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性良好,否则,说明装置漏气 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O Cl2+SO2+2H2O=4H++2Cl-+
MnCl2+Cl2↑+2H2O Cl2+SO2+2H2O=4H++2Cl-+![]()
![]() ×100% Cl2+2OH-=Cl-+ClO-+H2O
×100% Cl2+2OH-=Cl-+ClO-+H2O
【解析】
在A装置中,硫酸与Na2SO3发生反应Na2SO3+H2SO4==Na2SO4+H2O+SO2↑;生成的SO2通入B装置中;D装置中,浓盐酸与MnO2在加热条件下发生反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,生成的Cl2通入B装置中,与SO2在水中发生反应Cl2+SO2+2H2O==H2SO4+2HCl;为确保SO2全部转化为H2SO4,通入的Cl2应过量,过量的Cl2在C装置内被NaOH溶液吸收,发生反应的化学方程式为Cl2+2NaOH==NaCl+NaClO+H2O。
MnCl2+Cl2↑+2H2O,生成的Cl2通入B装置中,与SO2在水中发生反应Cl2+SO2+2H2O==H2SO4+2HCl;为确保SO2全部转化为H2SO4,通入的Cl2应过量,过量的Cl2在C装置内被NaOH溶液吸收,发生反应的化学方程式为Cl2+2NaOH==NaCl+NaClO+H2O。
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该从长颈漏斗往锥形瓶内添加水,通过形成液面差,确定装置的气密性,具体操作为:关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性良好,否则,说明装置漏气。答案为:关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性良好,否则,说明装置漏气;
(2)D装置中,MnO2与浓盐酸在加热条件下发生氧化还原反应,成MnCl2、Cl2和H2O,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。B装置中,SO2、Cl2与水发生氧化还原反应,生成两种酸,反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+
MnCl2+Cl2↑+2H2O。B装置中,SO2、Cl2与水发生氧化还原反应,生成两种酸,反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+![]() 。答案为:MnO2+4HCl(浓)
。答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;Cl2+SO2+2H2O=4H++2Cl-+
MnCl2+Cl2↑+2H2O;Cl2+SO2+2H2O=4H++2Cl-+![]() ;
;
(3)反应生成的bg白色沉淀为BaSO4,则由反应可建立下列关系式:Na2SO3——BaSO4,则原样品中Na2SO3的质量分数为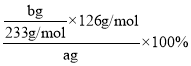 =
=![]() ×100%。答案为:
×100%。答案为:![]() ×100%;
×100%;
(4)C装置中,Cl2被NaOH溶液吸收,发生反应的化学方程式为Cl2+2NaOH==NaCl+NaClO+H2O,则反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。答案为:Cl2+2OH-

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】下列各项中I、II两个反应属于同一反应类型的是( )
选项 | 反应I | 反应II |
A |
| CH2=CH2→CH3CH2Cl |
B | CH3CH2Cl→CH3CH2OH | CH3CH2OH→CH3COOCH2CH3 |
C | CH3CH2OH→CH2=CH2 | CH3CH2OH→CH3CHO |
D | 油脂→甘油 |
|
A. AB. BC. CD. D