题目内容
4.关于氧化物Na2O2和Na2O,它们( )| A. | 阴阳离子个数比均为1:2 | B. | 都含有非极性共价键 | ||
| C. | 都与水发生氧化还原反应 | D. | 都属于碱性氧化物 |
分析 A、Na20是由钠离子和氧离子构成的离子化合物,Na202是由钠离子和过氧根离子构成的离子化合物;
B、Na20是由钠离子和氧离子构成的离子化合物,不含有非极性共价键;
C、Na20与水反应生成氢氧化钠,元素化合价不变;
D、碱性氧化物是指能与酸反应生成盐和水的金属氧化物.
解答 解:A、Na20是由钠离子和氧离子构成的离子化合物,电子式为 ,所以阴阳离子个数比是1:2,Na202是由钠离子和过氧根离子构成的离子化合物,电子式为
,所以阴阳离子个数比是1:2,Na202是由钠离子和过氧根离子构成的离子化合物,电子式为 ,阴阳离子个数比是1:2,故A正确;
,阴阳离子个数比是1:2,故A正确;
B、Na20是由钠离子和氧离子构成的离子化合物,不含有非极性共价键,故B错误;
C、Na20与水反应生成氢氧化钠,元素化合价不变,属于非氧化还原反应,故C错误;
D、因过氧化钠与酸反应生成盐、水和氧气,则过氧化钠不属于碱性氧化物,故D错误;
故选A.
点评 本题主要考查了物质的性质,掌握Na20与Na202的结构是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
14.请选择合适的试剂除去括号内的杂质.
| 序号 | 被提纯物(杂质) | 试剂 |
| ① | CH3CH3( CH2=CH2) | |
| ② | CH2=CH2(SO2) | |
| ③ | 乙酸乙酯 (乙酸) | |
| ④ | 乙醇(水) |
15.下列有关说法不正确的是( )
| A. | 常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 | |
| B. | 在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 | |
| C. | 加热0.1 mol•L-1Al2(SO4)3溶液,Al3+水解程度增大,溶液的酸性增强 | |
| D. | 常温下,pH=11的NaOH溶液与pH=3的醋酸等体积混合后所得溶液显酸性 |
19.下列说法正确的是( )
| A. | 金属钠着火,立即用泡沫灭火器灭火 | |
| B. | 酒精灯不慎着火,应立即吹熄 | |
| C. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| D. | 氢氟酸或浓硝酸存放在带橡胶塞的棕色玻璃瓶中 |
9.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法错误的是( )
| A. | 元素Y、Z、W简单离子半径依次增大 | |
| B. | 元素X与元素Y能形成多种化合物 | |
| C. | 元素Y、R分别与元素X形成的化合物的沸点:XmY>XmR | |
| D. | 元素Z、W、R的最高价氧化物对应水化物可以两两发生反应 |
16.下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
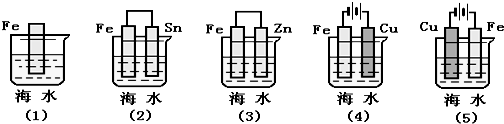

| A. | (2)(3)(4)(5)(1) | B. | (4)(3)(2)(5)(1) | C. | (5)(2)(1)(3)(4) | D. | (5)(3)(1)(2)(4) |
13.诺贝尔化学奖曾授予具有埃及和美国双重国籍的科学家艾哈迈德•泽维尔,以表彰他使“运用激光技术观测化学反应时原子的运动”成为可能.艾哈迈德•泽维尔证实了光可诱发下列反应:这一事实可用于解释人眼的夜视功能和叶绿素在光合作用中极高的光能利用率,以下叙述中正确的是( )

| A. | a、b是同一种物质 | B. | a、b的分子式都是C14H14 | ||
| C. | 上述变化是化学变化 | D. | a、b都是苯的同系物 |
14.随着人们生活水平的不断提高,各种各样的电源被大量应用.废电池必须进行集中处理的问题被提到日程,其中主要原因是( )
| A. | 自然资源日见缺乏,可从中回收利用金属材料 | |
| B. | 防止电池中汞、镉、铅等重金属离子及酸、碱对环境造成污染 | |
| C. | 不使电池中渗漏的电解液腐蚀其他物品 | |
| D. | 有很大的利润,促进经济发展 |