题目内容
4.a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的稳定性c>d;五种元素的原子,除稀有气体外e的原子子半径最小,则它们的原子序数由小到大的顺序是( )| A. | b、a、d、c、e | B. | e、b、a、d、c | C. | b、a、e、d、c | D. | c、d、e、a、b |
分析 a和b的最高价氧化物对应的水化物呈碱性,且碱性b>a,则金属性:b>a,原子序数a>b,
同周期元素从左到右,元素的金属性减弱,非金属性增强,原子半径在逐渐减小,据此解答.
解答 解:a和b的最高价氧化物对应的水化物呈碱性,且碱性b>a,则金属性:b>a,原子序数a>b,
c和d的气态氢化物的稳定性c>d,则c和d应为非金属性元素,同周期元素从左到右,元素的非金属性逐渐增强,对应的氢化物的稳定性增强,则原子序数c>d;五种元素的原子,除稀有气体外e的原子子半径最小,则e的原子序数最大,
故有原子序数:b<a<d<c<e,
故选A.
点评 本题考查元素的位置性质结构的相互关系,题目难度中等,本题注意从元素周期律的递变规律的角度解答,提示同学们在学习中要把相关基础知识牢固把握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.在化学反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1.5摩铜被氧化时( )
| A. | 有4mol硝酸被还原 | B. | 有1mol硝酸被还原 | ||
| C. | 转移6mol电子 | D. | 生成NO 22.4L |
15.某元素R的气态氢化物为H2R,则它的最高价氧化物对应的水化物的化学式为( )
| A. | HRO3 | B. | HRO4 | C. | H2RO4 | D. | H3RO4 |
12.已知短周期元素A和B的离子A2+和B2-具有相同的电子层结构,则下列叙述正确的是( )
| A. | A2+的半径比B2-的半径小 | B. | A的原子序数比B小 | ||
| C. | A和B原子的电子层数相等 | D. | A和B原子的最外层电子数相等 |
19.下列做法正确的是( )
| A. | 硝酸保存在带橡胶塞的棕色细口瓶中,置于冷暗处 | |
| B. | 用瓷坩埚来加热烧碱或纯碱使其熔化 | |
| C. | 用蒸馏水鉴别溴蒸气和二氧化氮气体 | |
| D. | 用盐酸为抛光液,抛光单晶硅 |
9.下列描述与所得结论正确的是( )
| 选项 | 描述 | 结论 |
| A | 化合物A在熔融状态下可以导电 | A为离子化合物 |
| B | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,无K+ |
| C | 将a、c两种金属相连后投到稀硫酸溶液中,a表面产生气泡 | 金属性a>c |
| D | NH4NO3溶液和稀HNO3溶液都可以使石蕊变红 | 它们均能电离出H+ |
| A. | A | B. | B | C. | C | D. | D |
16.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | 室温下,0.1 mol/LW的气态氢化物的水溶液的pH>1 | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | Y单质在一定条件下可以与氧化铁发生置换反应 | |
| D. | 原子半径由小到大的顺序:X<Y<Z<W |
13.下列有机物的结构简式表示正确的是( )
| A. | 乙酸乙酯:CH3COOCH3CH2 | B. | 硝基苯: | ||
| C. | 丙烯:CH2CHCH3 | D. | 二甲醚:CH3OCH3 |
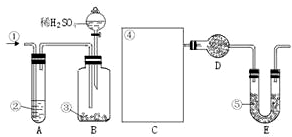 纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数.图中:①空气 ②某溶液 ③纯碱 ④某溶液 ⑤碱石灰
纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数.图中:①空气 ②某溶液 ③纯碱 ④某溶液 ⑤碱石灰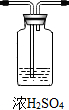 ;装置C的作用是吸收生成的二氧化碳气体中的水蒸气;如果撤去装置C,则会导致测定结果偏高(填“偏大”、“偏小”或“不变”)
;装置C的作用是吸收生成的二氧化碳气体中的水蒸气;如果撤去装置C,则会导致测定结果偏高(填“偏大”、“偏小”或“不变”)