题目内容
 Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.
Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.(1)写出甲元素基态原子的电子排布式
1s22s22p2
1s22s22p2
,乙元素的第一电离能比氧元素小
小
(填“大”或“小”).(2)若由甲、乙两元素形成的一种化合物硬度比金刚石大,则该化合物属于
原子
原子
晶体,其化学式为C3N4
C3N4
,估计合成这种物质必需的条件是高温高压
高温高压
,若要使其熔化,需破坏的作用力为共价键
共价键
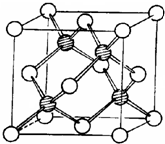
.Ⅱ.冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位
于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有
8
8
个水分子,冰晶胞与金刚石晶胞微粒排列方式相同的原因是C原子与O原子都为sp3杂化,冰中存在氢键,氢键具有方向性,每个水分子与相邻的4个水分子形成氢键
C原子与O原子都为sp3杂化,冰中存在氢键,氢键具有方向性,每个水分子与相邻的4个水分子形成氢键
.分析:Ⅰ.甲乙为短周期元素,甲元素有多种同素异形体,其中一种能导电,甲元素为C元素,乙元素未成对p电子数最多,p电子数为3个电子,甲乙同周期相邻,所以乙为N元素.
(1)甲元素为C元素,质子数为6,根据核外电子排布规律书写基态原子的电子排布式.
当电子在轨道中处于半满、全满、全空时,能量更低,电离能高大.
(2)C原元素、N元素形成的化合物,硬度比金刚石大,属于原子晶体,融化需破坏化学键,合成这种物质需高温高压.
根据C原子、N原子的最外层电子数,利用8电子稳定结构,判断原子成键,据此确定化学式;
Ⅱ.根据冰晶胞结构利用均摊法计算;
冰晶胞中存在氢键,氢键具有方向性,每个水分子与相邻的4个水分子形成氢键.
(1)甲元素为C元素,质子数为6,根据核外电子排布规律书写基态原子的电子排布式.
当电子在轨道中处于半满、全满、全空时,能量更低,电离能高大.
(2)C原元素、N元素形成的化合物,硬度比金刚石大,属于原子晶体,融化需破坏化学键,合成这种物质需高温高压.
根据C原子、N原子的最外层电子数,利用8电子稳定结构,判断原子成键,据此确定化学式;
Ⅱ.根据冰晶胞结构利用均摊法计算;
冰晶胞中存在氢键,氢键具有方向性,每个水分子与相邻的4个水分子形成氢键.
解答:解:Ⅰ(1)甲元素为C元素,质子数为6,核外电子排布为1s22s22p2,
乙元素为N元素,核外电子排布为1s22s22p3,2p电子有3个电子,处于半满状态,电子能量低,第一电离能比氧元素
小,故答案为:1s22s22p2;小;
(2)C原元素、N元素形成的化合物,硬度比金刚石大,属于原子晶体,
C原子、N原子的最外层电子数分别为4、5,形成8电子稳定结构,每个C原子与4个N原子成4个共价键,每个N原子与3个C原子成3个共价键,所以化合物中C原子与N原子个数比为3:4,化学式为C3N4,
C3N4属于原子晶体,,合成这种物质需高温高压,融化需破坏化学键,即破坏共价键.
故答案为:原子;C3N4;高温高压;共价键;
Ⅱ.冰晶胞结构图中空心球,实心球所示原皆为水分子,所以冰晶胞中含有水分子数为4+8×
+6×
=8,
C原子与O原子都为sp3杂化,冰晶胞中存在氢键,氢键具有方向性,每个水分子与相邻的4个水分子形成氢键.
故答案为:8; C原子与O原子都为sp3杂化,冰中存在氢键,氢键具有方向性,每个水分子与相邻的4个水分子形成氢键.
乙元素为N元素,核外电子排布为1s22s22p3,2p电子有3个电子,处于半满状态,电子能量低,第一电离能比氧元素
小,故答案为:1s22s22p2;小;
(2)C原元素、N元素形成的化合物,硬度比金刚石大,属于原子晶体,
C原子、N原子的最外层电子数分别为4、5,形成8电子稳定结构,每个C原子与4个N原子成4个共价键,每个N原子与3个C原子成3个共价键,所以化合物中C原子与N原子个数比为3:4,化学式为C3N4,
C3N4属于原子晶体,,合成这种物质需高温高压,融化需破坏化学键,即破坏共价键.
故答案为:原子;C3N4;高温高压;共价键;
Ⅱ.冰晶胞结构图中空心球,实心球所示原皆为水分子,所以冰晶胞中含有水分子数为4+8×
| 1 |
| 8 |
| 1 |
| 2 |
C原子与O原子都为sp3杂化,冰晶胞中存在氢键,氢键具有方向性,每个水分子与相邻的4个水分子形成氢键.
故答案为:8; C原子与O原子都为sp3杂化,冰中存在氢键,氢键具有方向性,每个水分子与相邻的4个水分子形成氢键.
点评:题目综合性较大,涉及核外电子排布、电离能、晶体、晶胞计算等,难度中等,注意当电子在轨道中处于半满、全满、全空时,能量更低,理解常见晶胞的结构.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目