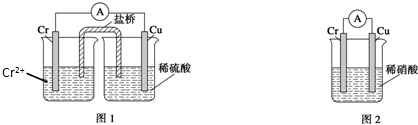
题目内容
10.下列说法错误的是( )| A. | 化合反应不一定是氧化还原反应 | |
| B. | 置换反应一定是氧化还原反应 | |
| C. | 氧化还原反应中,非金属单质一定是氧化剂 | |
| D. | 氧化还原反应中,金属单质一定是还原剂 |
分析 A.有单质参加的化合反应中一定有元素的化合价变化;
B.置换反应中一定有元素的化合价变化;
C.非金属单质可为氧化剂,也可为还原剂;
D.金属单质的化合价为0,处于最低价态.
解答 解:A.有单质参加的化合反应中一定有元素的化合价变化,则化合反应不一定是氧化还原反应,故A正确;
B.置换反应中一定有元素的化合价变化,则一定为氧化还原反应,故B正确;
C.非金属单质可为氧化剂,也可为还原剂,如氯气与水或碱的反应中,Cl元素的化合价既升高又降低,故C错误;
D.金属单质的化合价为0,处于最低价态,只有还原性,故D正确;
故选:C.
点评 本题考查氧化还原反应,为高考常见题型,注意把握元素的化合价及反应中的变化为解答的关键,侧重基本概念的考查,注意利用实例分析说明,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
20.在实验操作考查中,小明抽到的题目是“二氧化碳的制取,收集和验满”.下图是他的主要实验步骤,其中操作有误的是( )
| A. |  加入药品 | B. |  收集气体 | C. |  检查装置气密性 | D. |  气体验满 |
1.下列反应中,不属于氧化还原反应的是( )
| A. | 3Cl2+6KOH═5KCl+KClO3+3H2O | B. | 2FeBr2+3Cl2═2FeCl3+2Br2 | ||
| C. | SnCl4+2H2O═SnO2+4HCl | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
18.下列有关实验操作正确的是( )
| A. | 用pH试纸测量新制氯水的pH | |
| B. | 用10mL量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用量筒量取20mL0.5000 mol•L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.1000 mol•L-1H2SO4溶液 |
5.现有下列九种物质:
①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(每空一分):
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)将②加入NaOH的溶液中反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(每空一分):
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)将②加入NaOH的溶液中反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
15.在下列状态下,能导电的电解质是( )
| A. | 硝酸钾溶液 | B. | 液态氯化氢 | C. | 液态水银 | D. | 熔融氯化钠 |
16.下列说法正确的是( )
| A. | 向0.1mol•L-1氨水中加入适量NH4Cl(s),则混合液中c(NH4+)与c(NH3•H2O)之比增大 | |
| B. | 25℃时,0.1mol•L-1氨水和0.05 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 0.1mol•L-1 CH3COOH溶液中,c(CH3COO-)=c(H+) | |
| D. | 向0.1mol•L-1KNO3溶液中,滴加稀盐酸至溶液pH=5,此时混合液中c(K+)<c(NO3-) |