题目内容
【题目】表1是元素周期表的一部分:
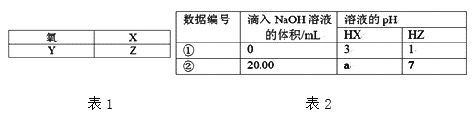
25℃时,用浓度为0.1000 mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.1000 mol/L的两种酸HX、HZ(忽略体积变化),实验数据如表2,下列判断正确的是
A. 表格中a<7
B. HX和HZ等体积混合后pH=1+lg2
C. Y和Z两元素的简单氢化物受热分解,前者分解温度高
D. 0.l000mol/LNa2Y的水溶液中:c(Y2—)+c(HY—)+c(H2Y)=0.1000mol/L
【答案】D
【解析】根据元素在周期表中的位置可知Y是S,X是F,Z是Cl。A.HF是弱酸,恰好反应时生成NaF水解,溶液显碱性,则表格中a>7,A错误;B.HX和HZ的pH分别是3和1,如果二者均是强酸,则等体积混合后pH=1+lg2,由于HF是弱酸,所以等体积后pH≠1+lg2,B错误;C. 氟元素的非金属性强于氯元素,则Y和Z两元素的简单氢化物受热分解,前者分解温度低,C错误;D.根据物料守恒可知0.l000 mol/L Na2S的水溶液中:c(S2—)+c(HS—)+c(H2S)=0.1000 mol/L,D正确。答案选D。

练习册系列答案
相关题目
