题目内容
【题目】碳酰氯(COC12),俗称光气,常温下为气体,化学性质不稳定,遇水迅速水解得到强酸,工业用途广泛,是化工制品的重要中间体。
(1)实验室可利用氧气与氯仿(CHCl3)反应得到光气和一种氢化物,写出氧气与氯仿(CHC13)反应的化学反应方程式:_____________________________。
(2)工业上,常用CO与氯气反应得到光气,其热化学方程式为:CO(g)+Cl2(g)![]() COCl2(g) △H=-108 kJ/mol,已知:1 molCl2(g)、1molCO(g)化学键断裂分别需要吸收能量243kJ、1072kJ,则1molCOCl2(g)中化学键断裂需要吸收能量________kJ。
COCl2(g) △H=-108 kJ/mol,已知:1 molCl2(g)、1molCO(g)化学键断裂分别需要吸收能量243kJ、1072kJ,则1molCOCl2(g)中化学键断裂需要吸收能量________kJ。
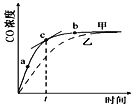
(3)光气的分解反应为 COCl2(g)![]() CO(g)+Cl2(g) △H=+l08kJ/mol。温度为T1时,该可逆反应在恒容密闭体系中,各物质的浓度与时间关系如下表所示:
CO(g)+Cl2(g) △H=+l08kJ/mol。温度为T1时,该可逆反应在恒容密闭体系中,各物质的浓度与时间关系如下表所示:
浓度/mol L-1 时间/min | COCl2(g) | CO(g) | Cl2(g) |
0 | 0.1300 | 0.0050 | 0.0050 |
5 | 0.0400 |
①在5 min 时恰好达到平衡状态,该反应在此温度下的平衡常数K=________(精确到小数点后两位)。
②0~5min 内,v(COCl2)=_________。
③若保持温度不变,再向容器中充入一定量COCl2 (g),重新达到平衡,此时COCl2 (g)的转化率a(COCl2)_________(填“增大”“减小”或“不变”),试用平衡常数解释原因______________________。
④保持其他条件不变,改变反应温度至T2,反应重新达到平衡,此时测得c(CO)=0.0850 mol/L,则T1________T2(填“>”、“<”、“=”),理由是________________________________。
【答案】 2CHCl3+O2 =2COC12+2HCl 1423 0.23 ②0.0180mol/(L·min) ③减小 改变条件时,Q=![]() 中三种物质浓度增大倍数相同,所以此时Q>K,平衡逆向移动,COCl2转化率降低 > 由各物质浓度变化可知,平衡逆向移动,由于正反应为吸热反应,因此改变的条件是降温
中三种物质浓度增大倍数相同,所以此时Q>K,平衡逆向移动,COCl2转化率降低 > 由各物质浓度变化可知,平衡逆向移动,由于正反应为吸热反应,因此改变的条件是降温
【解析】(1)实验室可利用氧气与氯仿(CHC13)反应得到光气和一种氢化物,根据质量守恒定律,该氢化物为氯化氢,氧气与氯仿(CHC13)反应的化学反应方程式为2CHCl3+O2 =2COC12+2HCl,故答案为:2CHCl3+O2 =2COC12+2HCl;
(2)设1molCOCl2(g)中化学键断裂需要吸收能量为x kJ,△H=反应物的键能-生成物的键能= (243kJ/mol +1072kJ) /mol -x kJ /mol = -108 kJ/mol,解得x=1423 kJ,故答案为:1423;
(3)① COCl2(g)![]() CO(g)+Cl2(g)
CO(g)+Cl2(g)
起始(mol/ L)0.13 0.005 0.005
反应 0.09 0.09 0.09
平衡 0.04 0.095 0.095
此温度下的平衡常数K=![]() =0.23,故答案为:0.23;
=0.23,故答案为:0.23;
②0~5min 内,v(COCl2)= ![]() =0.0180mol/(L·min),故答案为:0.0180mol/(L·min);
=0.0180mol/(L·min),故答案为:0.0180mol/(L·min);
③若保持温度不变,再向容器中充入一定量COC12 (g),相当于增大压强,Q=![]() 中三种物质浓度增大倍数相同,所以此时Q>K,平衡逆向移动,重新达到平衡,此时COC12 (g)的转化率减小,故答案为:减小;Q=
中三种物质浓度增大倍数相同,所以此时Q>K,平衡逆向移动,重新达到平衡,此时COC12 (g)的转化率减小,故答案为:减小;Q=![]() 中三种物质浓度增大倍数相同,所以此时Q>K,平衡逆向移动,COCl2转化率降低;
中三种物质浓度增大倍数相同,所以此时Q>K,平衡逆向移动,COCl2转化率降低;
④保持其他条件不变,改变反应温度至T2,反应重新达到平衡,此时测得c(CO)=0.0850 mol/L,说明平衡逆向移动,由于该反应正反应为吸热反应,因此改变反应温度至T2为降低温度,则T1>T2,故答案为:>;由各物质浓度变化可知,平衡逆向移动,由于正反应为吸热反应,因此改变的条件是降温。

 阅读快车系列答案
阅读快车系列答案