题目内容
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是( )
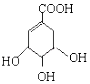
A.甲中A处通入CH4 , 电极反应式为CH4+10OH--8e-= ![]() +7H2O
+7H2O
B.乙中电解MgCl2溶液的总反应为2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D.甲、乙中电解质溶液的pH都增大
【答案】C
【解析】A项,乙为电解氯化镁溶液的装置,反应开始后观察到Fe电极附近出现白色沉淀,说明H+在铁电极放电,所以铁电极为阴极,则甲中B端为负极,通入CH4,反生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O,故A错误;B项,乙中电解氯化镁溶液的总反应为:Mg2++2Cl-+2H2O ![]() Cl2↑+H2↑+Mg(OH)2↓,故B错误;C项,由上分析可知,甲中每消耗标况下22.4L(1mol)CH4,转移8mol电子,则乙中产生4molCl2,故C正确;D项,甲中KOH参与反应,碱性减弱,PH减小,乙中氢离子放电,pH增大,故D错误。
Cl2↑+H2↑+Mg(OH)2↓,故B错误;C项,由上分析可知,甲中每消耗标况下22.4L(1mol)CH4,转移8mol电子,则乙中产生4molCl2,故C正确;D项,甲中KOH参与反应,碱性减弱,PH减小,乙中氢离子放电,pH增大,故D错误。
故答案为:C
反应开始后观察到x电极附近出现白色沉淀,说明X是阴极,氢离子放电,产生OH-,所以得到氢氧化镁沉淀,故A是负极,通入的是甲烷,据此进行分析即可.

练习册系列答案
相关题目