��Ŀ����
����Ŀ����ұ���ķ���������Ϊԭ����ȡ��ϸ�����������Ƚ��ͻ�����Ⱦ�ֿ��������Դ�������ʡ���֪���ҵ���Ҫ�ɷ�ΪAl2O3(����������SiO2��FeO��Fe2O3)�����Ʊ�ʵ���������£�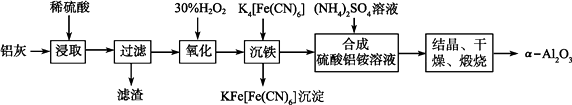
��1��д�����������ᷴӦ�漰�����ӷ���ʽ��
��2��ͼ�С�����������Ҫ�ɷ�Ϊ(�ѧʽ)��
��3����30%H2O2��Һ���������ӷ�Ӧ����ʽΪ��
��4������������茶��壬��������Ҫ��ӦΪ��4[NH4Al(SO4)2��12H2O] ![]() 2Al2O3��2NH3����N2����5SO3����3SO2����53H2O��������������ͨ����ͼ��ʾ��װ�á�
2Al2O3��2NH3����N2����5SO3����3SO2����53H2O��������������ͨ����ͼ��ʾ��װ�á�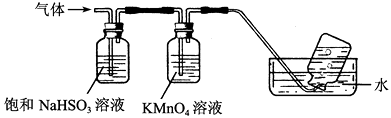
�ټ���ƿ���ռ�����������(�ѧʽ)��
����������NaHSO3��Һ���յ����ʳ���H2O(g)���(�ѧʽ)��
��KMnO4��Һ��ɫ(MnO ����ԭΪMn2��)�����������ӷ�Ӧ����ʽΪ��
���𰸡�
��1��Al2O3��6H��=2Al3����3H2O,FeO��2H��=Fe2����H2O,Fe2O3��6H��=2Fe3����3H2O
��2��SiO2
��3��2Fe2����H2O2��2H��=2Fe3����2H2O N2
��4�� SO3,NH3,2MnO ��5SO2��2H2O=2Mn2����5SO ![]() ��4H��
��4H��
����������1��Al2O3�����ᷴӦ������������ˮ���䷴Ӧ�ķ���ʽΪ��Al2O3��6H��=2Al3����3H2O��FeO��2H��=Fe2����H2O��Fe2O3��6H��=2Fe3����3H2O ��
��2��ͼ�С�����������Ҫ�ɷ�Ϊ�����������SiO2��
��3����30%H2O2��ҺFe2��������ΪFe3�������������ӷ�Ӧ����ʽΪ2Fe2����H2O2��2H��=2Fe3����2H2O ��
��4����NH4Al(SO4)2��12H2O�ֽ����ɵ�����NH3��SO3�������������գ�����������������գ����������ƿ���ռ�����������N2����NH3��������ˮ��NH3�����ܱ�����������Һ���գ�SO3��ˮ��Ӧ�����ᣬ��SO3Ҳ������������Һ���գ�������������NaHSO3��Һ���յ����ʳ���H2O��g�����SO3��NH3�������������£�KMnO4���������Ӧ������������Ӻ������ӣ��䷴Ӧ�����ӷ���ʽΪ��2MnO4��+5SO2+2H2O=2Mn2��+5SO42��+4H����

 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�