题目内容
【题目】实验室配制480mL 0.5mol·L-1的NaOH溶液,有如下操作步骤:
A.把称量好的NaOH固体放入小烧杯中,加适量蒸馏水溶解;
B.把①所得的溶液待冷却至室温后,用玻璃棒引流小心转入500mL容量瓶中;
C.继续向容量瓶中加蒸馏水至液面距离刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都小心转入容量瓶,并轻轻摇匀;
E.将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)配制前,应先用托盘天平准确称取NaOH固体_________克(精确到小数点后一位)。
(2)上述实验操作步骤正确顺序为(填序号)_________________。
(3)本实验用到的容量瓶上无需标记的是_______。
A.温度 B.刻度线 C.浓度 D.容积
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度___________。
【答案】10.0 A、B、D、C、E C 重新配制
【解析】
(1)据m=c·V·M计算需要溶质的质量;
(2)依据配制一定物质的量浓度溶液基本操作步骤排序;
(3)依据配制一定物质的量浓度溶液选择使用仪器要求分析判断;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析。
进行误差分析。
(1)配制480mL0.5mol/L的NaCl溶液,应选择500mL容量瓶,需要溶质的质量:m(NaOH)=0.5mol/L×0.5L×40g/mol=10.0g;
(2)配制一定物质的量浓度溶液基本操作步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签等,所以正确的操作顺序为:A、B、D、C、E;
(3)容量瓶上标有温度、容积、刻度线,无需标记的是浓度。答案选C。
(4)根据物质的量浓度定义式:c=![]() 可知:若加蒸馏水时不慎超过了刻度,会导致溶液体积偏大,而溶质的物质的量不变,因此会导致溶液浓度偏低,需要进行的操作是:将该溶液倒入指定的容器中重新配制。
可知:若加蒸馏水时不慎超过了刻度,会导致溶液体积偏大,而溶质的物质的量不变,因此会导致溶液浓度偏低,需要进行的操作是:将该溶液倒入指定的容器中重新配制。

【题目】用阳极X和阴极Y电解足量Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
选项 | 阳极X | 阴极Y | Z | W |
A | C | Fe | KCl | KOH |
B | Pt | Cu | CuSO4 | Cu(OH)2溶液 |
C | C | C | H2SO4 | H2O |
D | Ag | Fe | AgNO3 | AgNO3晶体 |
A. AB. BC. CD. D
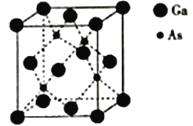
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
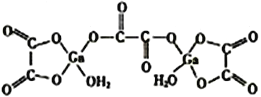
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。