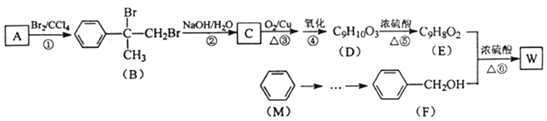
题目内容
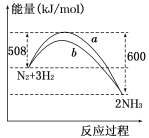
【题目】(1)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为___________________________________________________________。
(2)已知下列反应的反应热:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8kJ/mol
试计算下述反应的反应热2C(s)+O2(g)+2 H2(g)=CH3COOH(l)_______________________________。
【答案】N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ/mol △H=-488.3kJ/mol
2NH3(g) △H=-92kJ/mol △H=-488.3kJ/mol
【解析】
(1)根据图像可知,该反应为放热反应,反应物的总能量大于生成物的总能量,△H=放出的能量-吸收的能量=508kJ/mol-600kJ/mol=-92kJ/mol,该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g),△H=-92kJmol-1,故答案为:N2(g)+3H2(g)
2NH3(g),△H=-92kJmol-1,故答案为:N2(g)+3H2(g)![]() 2NH3(g),△H=-92kJmol-1。
2NH3(g),△H=-92kJmol-1。
(2)已知①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol;②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol;③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8kJ/mol;利用盖斯定律,将②×2+③×2-①可得2C(s)+O2(g)+2 H2(g)=CH3COOH(l) ΔH=(-393.5kJ/mol)×2+(-285.8kJ/mol)×2-(-870.3kJ/mol)=-488.3kJ/mol,故答案为:△H=-488.3kJ/mol。

【题目】下列选项中能发生反应,且甲组为取代反应,乙组为加成反应的是( )。
甲 | 乙 | |
A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
B | 油脂水解(催化剂、加热) | 苯与氢气(催化剂、加热) |
C | 淀粉水解制葡萄糖(催化剂) | 乙酸和乙醇的酯化反应(催化剂、加热) |
D | 乙烯与溴的四氯化碳溶液 | 甲烷与氯气(光照) |