题目内容
【题目】砷(33As)在元素周期表中与氮同主族,砷及其化合物被运用在农药、防腐剂、染料和医药等领域,及其多种合金中。
(1)砷原子次外层上的电子数为_____,砷化氢的电子式为_______。
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是两性偏酸性的氧化物,写出As2O3溶于浓盐酸的化学方程式__________。
(3)As2O3溶于热水生成的亚砷酸(H3AsO3),具有较强的还原性,分可用于治疗白血病,其水溶液存在多种微粒形态,各微粒的分布分数与溶液pH的关系如图:

①向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,反应的离子方程式为_________。
②电离平衡常数Ka1(H3AsO3)=________。
③Na2HAsO3溶液呈碱性,该溶液中c(H2AsO3-)_____c(AsO33-)(填“>”、“<”或“=”)。
④向含有HAsO32-的溶液中滴加氯水反应的离子方程式为_________。
【答案】 18  As2O3+6HCl=2AsCl3+3H2O H3AsO3+OH-=H2AsO3-+H2O 10-9.2 > HAsO32-+H2O+Cl2=H3AsO4+2Cl-
As2O3+6HCl=2AsCl3+3H2O H3AsO3+OH-=H2AsO3-+H2O 10-9.2 > HAsO32-+H2O+Cl2=H3AsO4+2Cl-
【解析】(1)本题考查电子式的书写,As位于第四周期VA族,根据核外电子排布规律,原子结构示意图为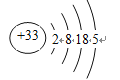 ,次外层电子数为18,其氢化物是AsH3,电子式为
,次外层电子数为18,其氢化物是AsH3,电子式为 ;(2)本题考查化学反应方程式的书写,As2O3是两性偏酸性的氧化物,与酸发生复分解反应,即反应方程式为As2O3+6HCl=2AsCl3+3H2O;(3)①本题考查离子反应方程式的书写,pH=11时,溶液中As元素以H2AsO3-形式存在,H3AsO3几乎完全消耗,因此离子反应方程式为H3AsO3+OH-=H2AsO3-+H2O ;②本题考查电离平衡常数的计算,H3AsO3是弱酸,存在H3AsO3
;(2)本题考查化学反应方程式的书写,As2O3是两性偏酸性的氧化物,与酸发生复分解反应,即反应方程式为As2O3+6HCl=2AsCl3+3H2O;(3)①本题考查离子反应方程式的书写,pH=11时,溶液中As元素以H2AsO3-形式存在,H3AsO3几乎完全消耗,因此离子反应方程式为H3AsO3+OH-=H2AsO3-+H2O ;②本题考查电离平衡常数的计算,H3AsO3是弱酸,存在H3AsO3 ![]() H++H2AsO3-,电离平衡常数Ka1=c(H2AsO3-)×c(H+)/c(H3AsO3),利用pH=9.2,此时c(H3AsO3)=c(H2AsO3-),因此Ka1=c(H+)=10-9.2;③考查酸式盐溶液的酸碱性,NaHAsO3溶液显碱性,说明HAsO3-以水解为主,因此c(H2AsO3-)>c(AsO33-);④考查氧化还原反应方程式的书写,HAsO32-中As显+3价,具有还原性,氯水具有强氧化性,把As氧化成+5价,即离子反应方程式为 HAsO32-+H2O+Cl2=H3AsO4+2Cl-。
H++H2AsO3-,电离平衡常数Ka1=c(H2AsO3-)×c(H+)/c(H3AsO3),利用pH=9.2,此时c(H3AsO3)=c(H2AsO3-),因此Ka1=c(H+)=10-9.2;③考查酸式盐溶液的酸碱性,NaHAsO3溶液显碱性,说明HAsO3-以水解为主,因此c(H2AsO3-)>c(AsO33-);④考查氧化还原反应方程式的书写,HAsO32-中As显+3价,具有还原性,氯水具有强氧化性,把As氧化成+5价,即离子反应方程式为 HAsO32-+H2O+Cl2=H3AsO4+2Cl-。


