题目内容
【题目】50mL0.50molL﹣1盐酸与50mL0.55molL﹣1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: 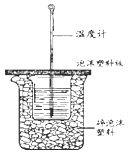
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)在实验过程中,该同学需要测定并记录的实验数据有(填序号).
A.盐酸的浓度
B.盐酸的温度
C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度
E.水的比热容
F.反应后混合溶液的终止温度
(3)中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容为4.18J/(g℃),酸与碱溶液的密度均为1g/cm3 . 通过计算可得中和热△H=
(4)实验中改用60mL0.50molL﹣1盐酸跟50mL0.55molL﹣1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”).
【答案】
(1)环形玻璃搅拌棒
(2)BDF
(3)﹣56.8kJ?mol﹣1
(4)不相等;相等
【解析】解:(1)中和热测定实验中,为了使酸碱充分反应,还需要用到环形玻璃搅拌棒,图示装置中还缺少的仪器为环形玻璃搅拌棒,所以答案是:环形玻璃搅拌棒;(2)计算酸碱中和反应放出的热量表达式为Q=mc△T,则在该实验过程中,该同学需要测定的实验数据有:B.盐酸的温度、D.氢氧化钠溶液的温度、F.反应后混合溶液的终止温度,
所以答案是:BDF;(3)放出的热量Q=4.18J/(g℃)×100g×3.4℃=1421.2J=1.4212kJ,50mL0.50molL﹣1盐酸与50mL0.55molL﹣1NaOH的稀烧碱溶液反应生成水的物质的量是:0.50mol/L×0.05L=0.025mol,所以生成1mol水放出的热量为: ![]() =56.8kJ/mol,则中和热△H=﹣56.8kJmol﹣1 ,
=56.8kJ/mol,则中和热△H=﹣56.8kJmol﹣1 ,
所以答案是:﹣56.8kJmol﹣1;(4)反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.50molL﹣1盐酸跟50mL0.55molL﹣1NaOH溶液进行上述实验时生成水的量增多,放出的热量会偏高;由于中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50molL﹣1盐酸跟50mL0.55molL﹣1NaOH溶液进行实验,与用50mL0.50molL﹣1盐酸与50mL0.55molL﹣1NaOH溶液的实验测得中和热数值相等,
所以答案是:不相等;相等.

 名校课堂系列答案
名校课堂系列答案
