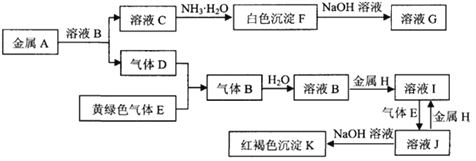
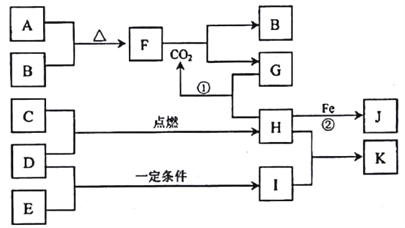
题目内容
【题目】下表是元素周期表的一部分,根据所给的10 种元素,回答下列间题.
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | F | Na | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)非金属性最强的元素是;
(2)Ne 原子结构示意图为;
(3)C 与N 中,原子半径较小的是;
(4)氯水具有漂白作用,是由于其中含有(填“HCl”或“HClO”)
(5)元素最高价氧化物对应的水化物中,碱性最强的是(填化学式),呈两性的是(填化学式);
(6)元素硅的氧化物常用于制造(填一种高性能的现代通讯材料的名称);
(7)如图为某有机物的球棍模型(其中 ![]() 代表氢原子代表
代表氢原子代表 ![]() 碳原子),
碳原子), 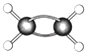 该有机物中碳元素与氢元素的质量比m(C):m(H)= . (相对原子质量C﹣12、H﹣1)
该有机物中碳元素与氢元素的质量比m(C):m(H)= . (相对原子质量C﹣12、H﹣1)
(8)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式 .
【答案】
(1)F
(2)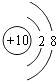
(3)N
(4)HClO
(5)NaOH;Al(OH)3
(6)光导纤维
(7)6:1
(8)MgCl2 ![]() Mg+Cl2↑
Mg+Cl2↑
【解析】解:(1)根据元素周期律知,位于元素周期表右上角的元素非金属性最强,所以这几种元素中,非金属性最强的是F元素,所以答案是:F;(2)Ne原子核外有10电子,其原子结构示意图为: 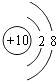 ,所以答案是:
,所以答案是: 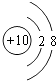 ;(3)同一周期中,元素的原子半径随着原子序数的增大而减小,所以N元素的原子半径较小,所以答案是:N;(4)氯水具有漂白性是因为氯水中含有次氯酸,所以答案是:HClO;(5)元素的金属性越强其最高价氧化物的水化物碱性越强,这几种元素中金属性最强的是Na元素,所以碱性最强的是NaOH,Al(OH)3呈两性,所以答案是:NaOH;Al(OH)3;(6)二氧化硅常用于制造光导纤维,所以答案是:光导纤维;(7)根据其球棍模型知,该物质是C2H4 , 乙烯中m(C):m(H)=(12×2):(1×4)=6:1,所以答案是:6:1;(8)镁是活泼金属,工业上采用电解熔融氯化镁的方法冶炼镁,电解反应方程式为MgCl2
;(3)同一周期中,元素的原子半径随着原子序数的增大而减小,所以N元素的原子半径较小,所以答案是:N;(4)氯水具有漂白性是因为氯水中含有次氯酸,所以答案是:HClO;(5)元素的金属性越强其最高价氧化物的水化物碱性越强,这几种元素中金属性最强的是Na元素,所以碱性最强的是NaOH,Al(OH)3呈两性,所以答案是:NaOH;Al(OH)3;(6)二氧化硅常用于制造光导纤维,所以答案是:光导纤维;(7)根据其球棍模型知,该物质是C2H4 , 乙烯中m(C):m(H)=(12×2):(1×4)=6:1,所以答案是:6:1;(8)镁是活泼金属,工业上采用电解熔融氯化镁的方法冶炼镁,电解反应方程式为MgCl2 ![]() Mg+Cl2↑,所以答案是:MgCl2
Mg+Cl2↑,所以答案是:MgCl2 ![]() Mg+Cl2↑.
Mg+Cl2↑.

 走进文言文系列答案
走进文言文系列答案【题目】无水硫酸铜是一种重要的化学试剂,工业上用低品位钢矿(合CuS、Cu2S、CuO,以及FeO、Fe2O3、SiO2等杂质)制备无水硫酸铜的流程如下图所示:
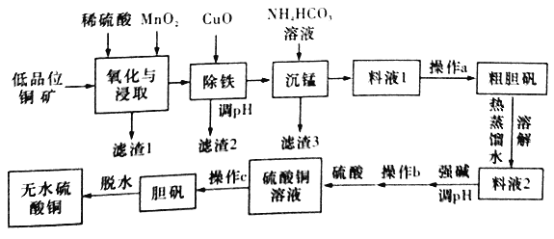
(NH4)2SO4、CuSO4的溶解度(g)部分数据如下表所示:
温度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
S(CuSO4)/g | 17 | 20.7 | 24.4 | 28.5 | 33.6 | 40 | 77 |
S[(NH4)SO4]/g | 73 | 75.4 | 78.1 | 81.0 | 84.5 | 87.8 | 102 |
(1)氧化与浸取过程中发生的反应之一为Cu2S被MnO2氧化时有一种非全属单质生成,则该反应的离子方程式为____________,滤渣1的主要成分是__________(填化学式),除铁时加入CuO能得到滤渣2的原理是__________________。
(2)除铁后,为了判断滤液中是否有Fe3+残留,请设计实验方案:__________。
(3)沉锰时还有一种酸性气体生成,则沉锰时发生反应的离子方程式为___________。(已知pH=8.8时,Mn2+开始沉淀)。
(4)为了从料液1中尽可能多地析出粗胆矾,操作a的内容是__________(填名称)。
(5)工业上利用上述原理制备胆矾。已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=8.0×10-38。离子浓度小于1×10-5mol/L时表明该离子已完全沉淀。常温下,若某溶液中c(Cu2+)=2.2 mol/L,c(Fe3+)=O.001mol/L,加入氧化铜除铁时,调节溶液pH范围为________(lg5=0.7)。