题目内容
某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度。现用粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品进行实验。实验装置如图所示(固定装置未画出):

(1)该反应的离子方程式为 。
(2)某学生欲用11.9 mol/L 浓硫酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀硫酸。该学生需要用量筒量取 mL上述浓硫酸进行配制。
(3)实验时除需测定粗锌的质量、氢气的体积之外,是否还需要其他物理量?如需要,请指出____________________,否则,此空不填。
(4)在加入药品之前需检查装置气密性,如何检查该装置的气密性:
。
(5)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量筒内气体的体积。
这三步操作的正确顺序是:________________________(请填写步骤代号)。
(6)如果实验中测得粗锌质量为a g,得到的氢气体积是b L(已折算成标准状况),水蒸气的影响忽略不计,粗锌中锌的质量分数的计算式为(用含a、b的代数式表示,不必化简):___________________。
(7)请提出另一种更简捷的实验方案:________________________________。
(1)Zn + 2H+ ![]() Zn2+ + H2↑(1分)
Zn2+ + H2↑(1分)
(2)16.8 (2分)
(3)测定实验时的温度、压强 (2分)
(4)向水槽中加水浸没导管,对试管微热,有气泡产生;停止加热,导管口形成一段水柱,一段时间内水柱不下降,表明气密性良好。(2分)
![]() (5)②①③(1分)
(5)②①③(1分)
(6)(2分)
(7)用适量且定量的粗锌与足量稀硫酸充分反应,滤出剩余固体,洗涤、干燥,称量反应前后固体的质量。(2分)

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
| |||||||||||||||
| |||||||||||||||||||||||||||
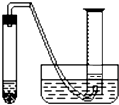 某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度.现有粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品.
某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度.现有粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品.

