��Ŀ����
����Ŀ���Ҷ��ᣨHOOC��COOH���ɼ�дΪH2C2O4���׳Ʋ��ᣬ��100�濪ʼ������157��ʱ��ʼ�ֽ⡣������KMnO4��Һ�ζ������ʵ�Na2C2O4��Ʒ����֪���ʲ���KMnO4��H2SO4��Һ��Ӧ����
ʵ�鲽�裺
ȷ��ȡ1g��ƷNa2C2O4���壬���100mL��Һ��ȡ��20.00mL����ƿ�С�����ƿ�м�������ϡH2SO4��Һ����0.016mol/L���������Һ�ζ����ζ����յ�ʱ���ĸ��������Һ25.00mL������֪��5H2C2O4+2KMnO4+3H2SO4=10CO2��+2MnSO4+K2SO4+8H2O��
(1)���������ҺӦװ��______________________________�ζ����С���������ʽ��������ʽ����
(2)�ζ����յ�ʱ��ʵ�������ǣ�___________________________________
(3)���в�������ʹ�������ƫ�ߵ���__________________________________��
A��ʢװ��Na2C2O4�ĵζ���û��ϴ
B��ʢװ���������Һ�ĵζ��ܵζ�ǰ���촦�����ݣ��ζ���������ʧ
C������ʱ�ζ�ǰ���ӣ��ζ�����
D����ƿ�в�������ˮ
(4)������Ʒ��Na2C2O4�Ĵ���___________________________________
���𰸡���ʽ ��Һ����ɫ��Ϊ��ɫ(�Ϻ�ɫ)���Ұ�����ڲ���ɫ B 67%
��������
�ȼ����20mL��Ʒ��Һ���ĸ�����ص����ʵ������ټ����100mL��Ʒ��Һ���ĸ�����ص����ʵ�����Ȼ����ݷ�Ӧ��������IJ����Ƶ����ʵ���������m=nM�����1g��������Ʒ�к��в����Ƶ����������������Ʒ�Ĵ��ȡ�
�����Ը��������Һ���������Ҿ���ǿ���������ܹ���ʴ��ʽ�ζ��ܵ���������Ӧ������ʽ�ζ�����ȡ��
��ˣ�������ȷ��������ʽ��
�ڵζ�����ǰ��ҺΪ��ɫ���ζ���������Һ����ɫ�����Եζ��յ������Ϊ����Һ����ɫ��Ϊ��ɫ(�Ϻ�ɫ)���Ұ�����ڲ���ɫ,
��ˣ�������ȷ��������Һ����ɫ��Ϊ��ɫ(�Ϻ�ɫ)���Ұ�����ڲ���ɫ��
��A.ʢװ��![]() �ĵζ���û��ϴ�����´���ҺŨ�ȼ�С�������ĸ��������Һ���ƫС���ⶨ���ƫС��
�ĵζ���û��ϴ�����´���ҺŨ�ȼ�С�������ĸ��������Һ���ƫС���ⶨ���ƫС��
B.ʢװ���������Һ�ĵζ��ܵζ�ǰ���촦���������ζ���������ʧ���������ĵı�Һ���ƫ�����ⶨ���ƫ����
C.����ʱ�ζ�ǰ�������ζ������������ĸ��������Һ���ƫС���ⶨ���ƫ����
D.��ƿ�в�������ˮ���Բⶨ�����Ӱ����
��ˣ�������ȷ������B��
��![]() ���������Һ�к��и�����ص����ʵ���Ϊ:
���������Һ�к��и�����ص����ʵ���Ϊ:![]() ��100mL����Ʒ��Һ��ȫ��Ӧ���ĸ�����ص����ʵ���Ϊ:
��100mL����Ʒ��Һ��ȫ��Ӧ���ĸ�����ص����ʵ���Ϊ:![]() �����ݷ�Ӧ5H2C2O4+2KMnO4+3H2SO4=10CO2��+2MnSO4+K2SO4+8H2O ����֪����
�����ݷ�Ӧ5H2C2O4+2KMnO4+3H2SO4=10CO2��+2MnSO4+K2SO4+8H2O ����֪����![]() ������Ʒ�к��в����Ƶ����ʵ���Ϊ:
������Ʒ�к��в����Ƶ����ʵ���Ϊ:![]() ,����Ϊ:
,����Ϊ:![]() ������
������![]() �Ĵ���Ϊ:
�Ĵ���Ϊ:![]() ��
��

 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�����Ŀ��ʵ�����������ʯβ��(��Ҫ�ɷ�ΪMgO������FeO��Fe2O3��Al2O3��)�Ʊ������Ȼ�þ����(MgCl2��6H2O)��ʵ���������£�
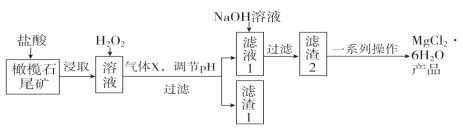
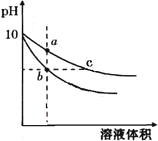
��֪���ֽ����������γ������������ʱ��pH���±���
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
��ʼ����ʱ | 7.6 | 2.7 | 4.2 | 9.6 |
������ȫʱ | 9.6 | 3.7 | 5.4 | 11.1 |
�ش��������⣺
(1)����ȡ�������У��ܼӿ��ȡ���ʵķ�����____________��__________(��д����)��
(2)����X�ĵ���ʽΪ________������1�������������Ƶ�һ�ָ�Ч�����߷��ӻ���������ˮ�����仯ѧʽΪ[Fe2(OH)n(SO4)(3��0.5n)]m�������������Ԫ�صĻ��ϼ�Ϊ________��
(3)����H2O2��Ŀ����______________________���������������е���H2O2������NaClO������Ҳ�ܴﵽͬ��Ŀ�ģ�������Ӧ�����ӷ���ʽΪ��________________________________��
(4)��һϵ�в�������Ҫ���������������ᣬȻ��____________________�����ˡ�ϴ�ӣ����õ��Ȼ�þ���塣
(5)ȷ��ȡ2.000 g�Ȼ�þ�����Ʒ��250 mL��ƿ�У���ˮ50 mLʹ����ȫ�ܽ⣬����100 mL���Ի���Һ����������Tָʾ������Һ�Ծƺ�ɫ���ڲ������£���0.5000 mol/L��EDTA����Һ���еζ����䷴Ӧԭ��ΪMg2+��Y4- ==MgY2-���ζ��յ�ʱ����EDTA����Һ�����19.00 mL��
�����Ʒ��MgCl2��6H2O����������Ϊ________(���������λ��Ч����)��
�����еζ������ᵼ�²������ƫ�ߵ���________(����ĸ)��
a���ζ��յ�ʱ���Ӷ��� b����ƿϴ�Ӻ�û�и���
c���ζ�ʱ��ƿ����Һ�彦�� d���ζ��ܵζ�ǰ�����ݣ��ζ���������ʧ