题目内容
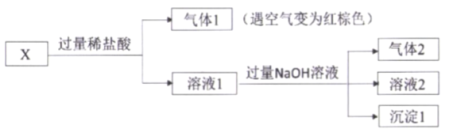
【题目】某固体混合物X,含有FeSO4、Fe(NO3)3、Al(NO3)3、NH4Cl、 Na2CO3 中的几种,进行如下实验:
下列说法不正确的是
A.混合物X中必定含有NH4Cl、FeSO4,不含Na2CO3
B.灼烧沉淀1,可以得到红棕色物质
C.将足量的气体2通入溶液1中,将出现沉淀
D.往溶液2中通入足量的CO2,若没有出现沉淀,说明X中不含Al(NO3)3
【答案】A
【解析】
X中加入过量的稀盐酸,生成气体1,遇到空气变成红棕色,可知该气体一定含有NO,不能确定是否含有CO2,因此不能确定是否含有Na2CO3;加入盐酸的过程中发生了氧化还原反应,一定含有FeSO4,还需要NO3-,则可能含有Fe(NO3)3和Al(NO3)3其中的1种或2种。溶液1中加入过量的NaOH,生成气体2,为NH3,可知一定含有NH4Cl,生成沉淀1,可能是Fe2+氧化生成的Fe3+,与OH-结合生成Fe(OH)3。
根据分析可知,一定含有的是FeSO4、NH4Cl,其他物质不能确定。
A.根据分析Na2CO3不能确定,A错误,符合题意;
B.沉淀1中含有Fe(OH)3,灼烧Fe(OH)3可得到Fe2O3,其颜色为红棕色,B正确,不选;
C.溶液1中含有Fe3+,通入NH3,会生成Fe(OH)3沉淀,C正确,不选;
D.如果含有Al(NO3)3,在加入过量NaOH溶液后,溶液2中含有AlO2-,通入CO2,会生成Al(OH)3沉淀,因此如果通入CO2,没有出现沉淀,说明不含Al(NO3)3,D正确,不选。
答案选A。

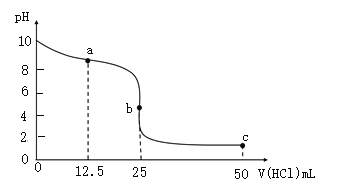
【题目】已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
A. 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B. 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
C. NaCN中通入少量CO2发生的化学反应为:NaCN+CO2+H2O=HCN+NaHCO3
D. 稀释HCN溶液过程中,![]() 减小
减小