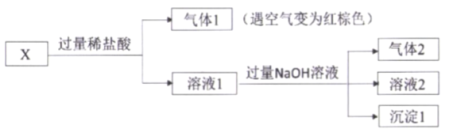
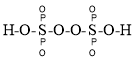题目内容
【题目】将3mol A与3mol B混合于3L的密闭容器中,发生如下反应:2A(g)+3B(g)![]() 2C(g)+nD(g),2s后达平衡A的转化率为50%,测得v(D)=0.25molL-1s-1,下列推断正确的是( )
2C(g)+nD(g),2s后达平衡A的转化率为50%,测得v(D)=0.25molL-1s-1,下列推断正确的是( )
A.v(B)=0.25molL-1s-1B.C的体积分数为30%
C.B的转化率为25%D.n=2
【答案】D
【解析】
将3mol A与3mol B混合于3L的密闭容器中,2s后达平衡A的转化率为50%,则转化的A为3mol×50%=1.5mol,则:
2A(g)+3B(g)![]() 2C(g)+nD(g)
2C(g)+nD(g)
起始量(mol):3 3 0 0
转化量(mol):1.5 2.25 1.5 0.75n
平衡量(mol):1.5 0.75 1.5 0.75n
A.v(B)=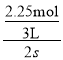 =0.375mol/(L·s),故A错误;
=0.375mol/(L·s),故A错误;
B.v(D)=0.25molL-1s-1,则0.75n mol=v(D)=0.25molL-1s-1×2s×3L,解得n=2,C的体积分数=![]() =28.6%,故B错误;
=28.6%,故B错误;
C.B的转化率=![]() ×100%=75%,故C错误;
×100%=75%,故C错误;
D.v(D)=0.25molL-1s-1,则0.75n mol=v(D)=0.25molL-1s-1×2s×3L,解得n=2,故D正确;
故答案为D。

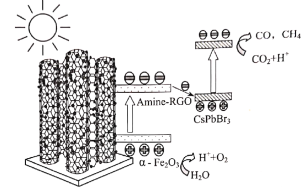
【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如下:
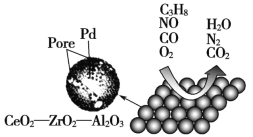
(1)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是_______________。
(2)图中互为等电子体的两种气体分子是_____________。
(3)C3H8中所有碳原子的杂化方式是___________。
(4)图中属于非极性的气体分子是_______________________。
Fe、Mn元素的部分电离能数据列于下表中
元素 | Fe | Mn | |
电离能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是_____________。
(6)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为_____________,[Ni(CO)4]的配体是_________,配位原子是__________。
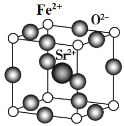
(7)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有______个。
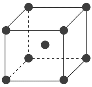
(8)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为______________g·cm-3(用来a、b、NA表示计算结果)。
【题目】元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七种元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
请回答:
(1)②所代表元素的名称为______
(2)七种元素中,非金属性最强的元素是______(填元素符号),最高价氧化物的水化物酸性最强的是_______(填化学式),最高正化合价与最低负化合价的代数和为4的元素是_______(填元素符号)。
(3)②、④、⑥所对应元素中原子半径最小的是______(填元素符号),简单离子半径最大的是______(填离子符号)。