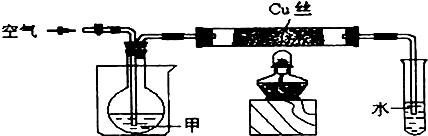
题目内容
有一混合气体由一种气态烯烃A和一种气态烷烃B组成,它对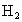 的相对密度为12,把1体积的混合物和4体积氧气混合,放在密闭容器中,用电火花点燃,使两种烃都充分氧化,如果反应前后的温度都为150℃,测得容器内压强由反应前的
的相对密度为12,把1体积的混合物和4体积氧气混合,放在密闭容器中,用电火花点燃,使两种烃都充分氧化,如果反应前后的温度都为150℃,测得容器内压强由反应前的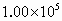 增强到反应后的
增强到反应后的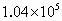 .问烃A、B各是什么烃?它们体积比是多少?
.问烃A、B各是什么烃?它们体积比是多少?
答案:略
解析:
提示:
解析:
|
由题意可知混合烃的平均式量  . .
∴气态烷烃 B必为 . .
又∵  燃烧前后物质的量不变, 燃烧前后物质的量不变,
∴容器内压强增大是由烯烃 A燃烧引起的.设烯烃 A的分子式为 ,占a体积. ,占a体积.
∴ 
联立①②解得: a=0.2,n=4∴ A为1-丁烯或2-丁烯或2-甲基-1-丙烯,A、B的体积比为1∶4. |
提示:
|
本题考查平均式量和平均分子式的运用及物质的量与压强的关系,培养学生分析问题的综合能力. |

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目