题目内容
短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数是其周期序数的三倍。回答下列问题:
(1)甲在元素周期表中的位置是 。
(2)原子半径:甲 丁(填“>”或“<”)。
(3)乙与戊组成化合物的电子式为 ,其中化学键的类型是 (填“极性”或“非极性”)共价键。
(4)元素的非金属性:甲 丙(填“>”或“<”),下列事实能说明该结论的是 。
A、丙的氢化物稳定,甲的氢化物不稳定
B、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸
C、丙的最高价氧化物对应的水化物易溶于水,甲的难溶
(5)丙的单质的电子式为 ,乙与丁的原子构成的三原子分子的电子式为 。
| 乙 | 丙 | 丁 | |
| 甲 | | | 戊 |
(2)原子半径:甲 丁(填“>”或“<”)。
(3)乙与戊组成化合物的电子式为 ,其中化学键的类型是 (填“极性”或“非极性”)共价键。
(4)元素的非金属性:甲 丙(填“>”或“<”),下列事实能说明该结论的是 。
A、丙的氢化物稳定,甲的氢化物不稳定
B、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸
C、丙的最高价氧化物对应的水化物易溶于水,甲的难溶
(5)丙的单质的电子式为 ,乙与丁的原子构成的三原子分子的电子式为 。
(1)第三周期第ⅣA族 (2)> (3) 极性
极性
(4)< A B
(5)
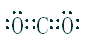
 极性
极性(4)< A B
(5)

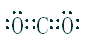
试题分析:丁所处的主族序数是其周期序数的三倍,所以丁只能是O,甲、乙、丙、戊分别为Si、C、N、Cl,(1)甲为Si,其在元素周期表中的位置是第三周期第ⅣA族;(2)根据同一周期,原子半径从左往右缩小,可知甲>丁;(3)乙与戊组成化合物为CCl4,其电子式为
 ;化学键的类型为极性共价键;(4)甲为Si,丙为N,所以非金属性是甲<丙,能说明该结论是因为一、丙的氢化物稳定,甲的氢化物不稳定;二、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸,所以答案为 A B。(5)丙的单质为氮气,其电子式为
;化学键的类型为极性共价键;(4)甲为Si,丙为N,所以非金属性是甲<丙,能说明该结论是因为一、丙的氢化物稳定,甲的氢化物不稳定;二、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸,所以答案为 A B。(5)丙的单质为氮气,其电子式为 ;乙与丁的原子构成的三原子分子为二氧化碳,其电子式为
;乙与丁的原子构成的三原子分子为二氧化碳,其电子式为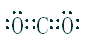 。
。点评:本题考查了元素周期表,元素性质,是高考的考查重点,该题关键是根据丁所处的主族序数是其周期序数的三倍,推断出丁为O,从而推断出其他,该题难度不大。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目