题目内容
下列各组物质的性质正确的是
| A.酸性:HClO4>H2SO4>H3PO4>H2CO3 |
| B.稳定性:H2S>HCl>HBr>HI |
| C.粒子半径:Br->K+>S2->S |
| D.还原性:Na>S2->Br->Cl- |
AD
判断非金属元素最高价氧化物对应的水化物——含氧酸的酸性时,需找出成酸元素在元素周期表中的位置,再依据元素周期律知识判断其非金属性强弱,非金属性强者,含氧酸酸性就强。A项中由于元素的非金属性:Cl>S>P>C,所以排列正确。
元素非金属性越强,气态氢化物越稳定,最低价简单阴离子的还原性越弱。B项应为:HCl>HBr>HI>H2S,D项正确。
判断粒子半径有以下规律:当电子层数及核电荷数均不同时,电子层数越多,半径越大。如Br->S2-;当电子层数相同,核电荷数不同时,核电荷数越大的,半径越小,如S2->K+,S>K+;当核电荷数、电子层数均相同时,核外电子数越多的,半径越大,如S2->S。
元素非金属性越强,气态氢化物越稳定,最低价简单阴离子的还原性越弱。B项应为:HCl>HBr>HI>H2S,D项正确。
判断粒子半径有以下规律:当电子层数及核电荷数均不同时,电子层数越多,半径越大。如Br->S2-;当电子层数相同,核电荷数不同时,核电荷数越大的,半径越小,如S2->K+,S>K+;当核电荷数、电子层数均相同时,核外电子数越多的,半径越大,如S2->S。

练习册系列答案
相关题目
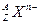 核外有18个电子,则它的质子数为_________,核内中子数为_________。
核外有18个电子,则它的质子数为_________,核内中子数为_________。