题目内容
(6分)0.15 mol某金属单质与足量的稀硫酸充分作用后,在标准状况下生成5.04 L H2和25.65 g该金属的硫酸盐,若该金属原子核内的质子数比中子数少一个,试通过计算推导该金属在周期表中的位置。
第3周期第ⅢA族。
(1)生成H2的物质的量n(H2)="5.04" L/22.4 L·mol-1="0.225" mol,电子转移总数为n(e-)="0.45" mol。
(2)假设金属的化合价为+n,则0.15 n=0.45,n=3,由此推知金属的硫酸盐的化学式为:M2(SO4)3(M为金属)。
(3)假设金属的摩尔质量为M,则
(2M+96×3)=25.65/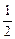 ×0.15
×0.15
M=27(g·mol-1)
(4)金属的相对原子质量为27,其质量数为27,假设质子数为Z,则Z+(Z+1)=27,Z=13,即金属元素为Al元素,在周期表中第ⅢA族,第3周期。
(2)假设金属的化合价为+n,则0.15 n=0.45,n=3,由此推知金属的硫酸盐的化学式为:M2(SO4)3(M为金属)。
(3)假设金属的摩尔质量为M,则
(2M+96×3)=25.65/
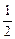 ×0.15
×0.15M=27(g·mol-1)
(4)金属的相对原子质量为27,其质量数为27,假设质子数为Z,则Z+(Z+1)=27,Z=13,即金属元素为Al元素,在周期表中第ⅢA族,第3周期。

练习册系列答案
相关题目