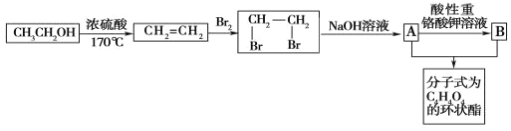
题目内容
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
![]() 已知:①
已知:①![]()
②![]()
③![]() .
.
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ______ .
![]() 生产甲醇的原料CO和
生产甲醇的原料CO和![]() 可由反应
可由反应![]() 得到.
得到.
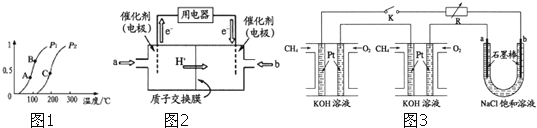
①一定条件下![]() 的平衡转化率与温度、压强的关系如图
的平衡转化率与温度、压强的关系如图![]() 则
则![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() 、B、C三点处对应平衡常数
、B、C三点处对应平衡常数![]() 、
、![]() 、
、![]() 的大小顺序为 ______ .
的大小顺序为 ______ .
②![]() 时,将
时,将![]() 和
和![]() 通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 ______
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 ______ ![]() 填序号
填序号![]() .
.
![]() .容器的压强恒定
.容器的压强恒定
![]() .容器内气体密度恒定
.容器内气体密度恒定
![]() 正
正![]() 逆
逆![]()
![]() 单位时间内消耗
单位时间内消耗![]() 同时生成
同时生成![]()
![]() 甲醇燃料电池
甲醇燃料电池![]() 简称
简称![]() 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 ______ 极
由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() ,其电极反应式为 ______ .
,其电极反应式为 ______ .
![]() 某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为
某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为![]() 闭合K后,若每个电池甲烷用量均为
闭合K后,若每个电池甲烷用量均为![]() 标况
标况![]() ,且反应完全,则理论上通过电解池的电量为 ______
,且反应完全,则理论上通过电解池的电量为 ______ ![]() 列式计算.法拉第常数
列式计算.法拉第常数![]() ,若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 ______ .
,若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 ______ .
【答案】![]()
![]()
![]() ac 负
ac 负 ![]()
![]() 13
13
【解析】
(1)根据热化学方程式利用盖斯定律计算反应热并书写热化学方程式;
(2)①在200℃时,看不同压强下CO的转化率大小,结合化学方程式中反应前后气体的体积变化解答;正反应吸热,随温度升高,平衡正向移动,化学平衡常数K增大;
②可逆反应达到平衡状态时,正逆反应速率相等各组分浓度保持不变;
(3)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,正极上是氧气得到电子发生还原反应,酸性溶液中生成水;
(4)电解氯化钠溶液的化学方程式为2NaCl+2H2O=2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e-~8molNaOH计算.
![]() 根据盖斯定律,将已知反应
根据盖斯定律,将已知反应![]() 得到
得到![]() ,所以该反应的
,所以该反应的![]() ,即
,即![]() ,故答案为:
,故答案为:![]() ;
;
![]() 在图a的
在图a的![]() 位置,平行与纵轴画一条虚线,可见
位置,平行与纵轴画一条虚线,可见![]() 的转化率
的转化率![]() ,在
,在![]() 反应中,生成物的气体体积大于反应物,压强增大时平衡向逆向移动,故
反应中,生成物的气体体积大于反应物,压强增大时平衡向逆向移动,故![]() ,正反应吸热,随温度升高,平衡正向移动,化学平衡常数K增大,所以
,正反应吸热,随温度升高,平衡正向移动,化学平衡常数K增大,所以![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
![]() 可逆反应达到平衡状态时,正逆反应速率相等各组分浓度保持不变,
可逆反应达到平衡状态时,正逆反应速率相等各组分浓度保持不变,
![]() 反应前后气体体积不同,所以容器的压强恒定时反应达到平衡状态,故a正确;
反应前后气体体积不同,所以容器的压强恒定时反应达到平衡状态,故a正确;
![]() 容器体积不变,气体质量不变,所以容器内气体密度始终恒定,故b错误;
容器体积不变,气体质量不变,所以容器内气体密度始终恒定,故b错误;
![]() 正
正![]() 逆
逆![]() ,说明正逆反应速率相等,反应达到平衡状态,故c正确;
,说明正逆反应速率相等,反应达到平衡状态,故c正确;
![]() 单位时间内消耗
单位时间内消耗![]() 同时生成
同时生成![]() ,都是正反应速率,不能说明反应达到平衡状态,故d错误;故答案为:ac;
,都是正反应速率,不能说明反应达到平衡状态,故d错误;故答案为:ac;
![]() 根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为
根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为![]() ,正极上氧气得电子发生还原反应,电极反应式为
,正极上氧气得电子发生还原反应,电极反应式为![]() ,故答案为:负;
,故答案为:负;![]() ;
;
![]() 电解氯化钠溶液的化学方程式为
电解氯化钠溶液的化学方程式为![]() ,可知关系式
,可知关系式![]() ,故若每个电池甲烷通入量为
,故若每个电池甲烷通入量为![]() 标准状况
标准状况![]() ,生成
,生成![]() ,
,![]() ,
,![]() ;电解池通过的电量为
;电解池通过的电量为![]() 题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算
题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算![]() ,故答案为:
,故答案为:![]() ;13。
;13。

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案