题目内容
5.用惰性电极电解含KI、CuCl2、Na2SO4浓度均为0.2mol•L-1的溶液1L,则(1)开始电解时的离子方程式为2I-+Cu2+$\frac{\underline{\;电解\;}}{\;}$Cu+I2;
(2)当阴极开始放H2时,阳极的电极反应式为2Cl--2e-=Cl2;
(3)当阳极开始放Cl2时,阴极的电极反应式为Cu2++2e-=Cu.
分析 (1)用惰性电极电解含KI、CuCl2、Na2SO4的溶液,开始电解时阳极碘离子失电子发生氧化反应,阴极铜离子得电子发生还原反应;
(2)当阴极开始放H2时,即铜离子反应完全,转移电子为0.2×2=0.4mol,阳极为氯离子失电子发生氧化反应;
(3)当阳极开始放Cl2时,即碘离子反应完全,转移电子为0.2×1=0.2mol,阴极为铜离子得电子发生还原反应.
解答 解:(1)用惰性电极电解含KI、CuCl2、Na2SO4的溶液,开始电解时阳极碘离子失电子发生氧化反应,阴极铜离子得电子发生还原反应,所以开始电解时的离子方程式为2I-+Cu2+$\frac{\underline{\;电解\;}}{\;}$Cu+I2;故答案为:2I-+Cu2+$\frac{\underline{\;电解\;}}{\;}$Cu+I2;
(2)当阴极开始放H2时,即铜离子反应完全,转移电子为0.2×2=0.4mol,阳极为氯离子失电子发生氧化反应,反应式为:2Cl--2e-=Cl2;故答案为:2Cl--2e-=Cl2;
(3)当阳极开始放Cl2时,即碘离子反应完全,转移电子为0.2×1=0.2mol,阴极为铜离子得电子发生还原反应,反应式为:Cu2++2e-=Cu;故答案为:Cu2++2e-=Cu.
点评 本题考查了混合电解的计算应用,电极反应,离子得放电顺序时解题关键,题目难度中等.

练习册系列答案
相关题目
15.NO对于心脑血管系统功能的改善具有重要作用.下列关于NO的描述不正确的是( )
| A. | 难溶于水 | |
| B. | 可由氮气和氧气在放电条件下反应生成 | |
| C. | 常温下能与氧气化合 | |
| D. | 红棕色气体 |
13.下列氧原子的电子排布图中,正确的是( )
| A. | 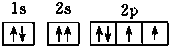 | B. | 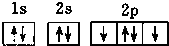 | ||
| C. | 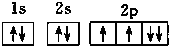 | D. | 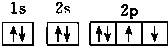 |
20.在一定条件下,对反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,下列叙述正确的是( )
| A. | 3v(NH3)=2v(H2O) | |
| B. | 在此条件下,该反应不一定能自发进行 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若降低温度,达到新的化学平衡时,NO的体积分数将增大 |
10.下列说法中正确的是( )
| A. | NaHSO4显强酸性,因此从组成上分类它应该属于酸 | |
| B. | 含Fe元素质量分数为70%的Fe2O3是纯净物 | |
| C. | CuSO4•5H2O是混合物 | |
| D. | 显碱性的物质一定为碱 |
17.用NA表示阿伏伽德罗常数的值,下列判断正确的是( )
| A. | 8g O2含有4NA个电子 | |
| B. | 1L 1mol•L-1的H2SO4溶液所含氧原子数为4NA | |
| C. | 标准状况下,22.4L O2和CO2的混合气体所含原子数为2.5NA | |
| D. | 标准状况下,22.4L CCl4含有NA个分子 |
15.下列离子方程式正确的是( )
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| C. | 向FeBr2溶液中通入等物质的量的氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O |