题目内容
10.下列说法中正确的是( )| A. | NaHSO4显强酸性,因此从组成上分类它应该属于酸 | |
| B. | 含Fe元素质量分数为70%的Fe2O3是纯净物 | |
| C. | CuSO4•5H2O是混合物 | |
| D. | 显碱性的物质一定为碱 |
分析 A、酸是在水溶液中电离出的阳离子全部是氢离子的化合物;
B、计算Fe2O3中铁元素的质量分数分析;
C、结晶水合物为化合物;
D、水解的盐也可以使溶液显碱性;
解答 解:A、酸是在水溶液中电离出的阳离子全部是氢离子的化合物,NaHSO4显强酸性,电离出的阳离子为Na+、H+,属于盐,故A错误;
B、计算Fe2O3中铁元素的质量分数分析,Fe2O3中铁元素质量分数为70%,为纯净物,故B正确;
C、结晶水合物为化合物,CuSO4•5H2O是纯净物,故C错误;
D、水解的盐也可以使溶液显碱性,如碳酸钠溶液中碳酸根离子水解,溶液显碱性,故D错误;
故选A.
点评 本题考查了物质分类方法,盐类水解分析,注意酸概念的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
2.下列各溶液中,微粒物质的量浓度关系正确的是( )
| A. | 0.1mol/L Na2S溶液中:c(Na+)=2s(S2-)+2c(HS-)+2c(H2S) | |
| B. | 0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)>c(CO32-) | |
| C. | 0.1mol/L(NH4)2SO4溶液中,c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1mol/L NaHCO3溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
19.广口瓶在基础化学实验中应用广泛,下列由广口瓶组装的装置及其操作与应用正确的是( )
| 选项 | 装置 | 操作与应用 |
| A | 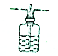 | 在广口瓶中盛放蒸馏水,用于吸收在水中溶解度较小的气体 |
| B | 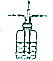 | 在广口瓶中盛放浓硫酸,左右导管中分别通入H2和N2,并按比例混合这两种气体 |
| C |  | 在广口瓶中盛放蒸馏水,用于测定易溶于水的气体的体积 |
| D | 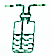 | 在广口瓶中盛放蒸馏水,用于吸收易溶于水的气体 |
| A. | A | B. | B | C. | C | D. | D |
1.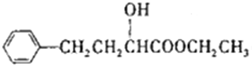 (2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:
(2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:
已知:
实验装置:
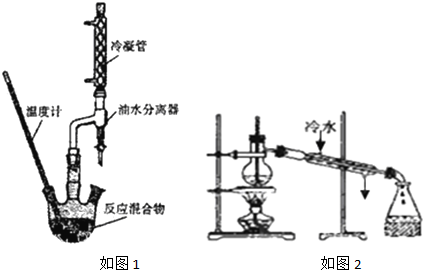
实验步骤:
①按如图1装置连接仪器
②将18.00g 2-羟基-4-苯基丁酸加入三颈瓶中,加入20mL无水乙醇和适量浓硫酸,再加入几块沸石.
③加热至70℃左右保持恒温半小时.
④分离、提纯三颈瓶中粗产品,得到有机产品.
⑤精制产品,得到产品18.72g.
请回答下列问题:
(1)写出制备反应的化学方程式: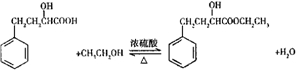 .
.
(2)加入原料时,能否最先加入浓硫酸?否.油水分离器的作用是及时分离产物水,促进平衡向生成酯的反应方向移动.
(3)本实验的加热方式宜用水浴加热.如果温度过高,或浓硫酸的量过多,制备产率会减小(填“增大”、“减小”或“不变”).
(4)分离提纯产品:取三颈瓶中混合物加入足量的饱和碳酸钠溶液,分液得到有机层.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”)
(5)产品精制:精制产品的实验装置如图2所示,试分析装置是否合理,不合理(填“合理”或“不合理”),若不合理将如何改进:温度计处在蒸馏烧瓶的支管口处,冷却水应从下口进上口出.(若装置合理,此空不作答).
(6)本实验得到产品的产率为90%.
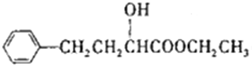 (2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:
(2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:已知:
| 乙醇 | 2-羟基-4-苯基丁酸 | 2-羟基-4-苯基丁酸乙酯 | |
| 相对分子质量 | 46 | 180 | 208 |
| 状态 | 无色液体 | 白色固体 | 无色液体 |
| 沸点/℃ | 78.4 | 356.9 | 212 |
| 密度/g/cm3 | 0.789 | 1.219 | 1.075 |
| 溶解性 | 易溶于水、有机溶剂 | 能溶于水,易溶于有机溶剂 | 难溶于水,易溶于有机溶剂 |

实验步骤:
①按如图1装置连接仪器
②将18.00g 2-羟基-4-苯基丁酸加入三颈瓶中,加入20mL无水乙醇和适量浓硫酸,再加入几块沸石.
③加热至70℃左右保持恒温半小时.
④分离、提纯三颈瓶中粗产品,得到有机产品.
⑤精制产品,得到产品18.72g.
请回答下列问题:
(1)写出制备反应的化学方程式:
 .
.(2)加入原料时,能否最先加入浓硫酸?否.油水分离器的作用是及时分离产物水,促进平衡向生成酯的反应方向移动.
(3)本实验的加热方式宜用水浴加热.如果温度过高,或浓硫酸的量过多,制备产率会减小(填“增大”、“减小”或“不变”).
(4)分离提纯产品:取三颈瓶中混合物加入足量的饱和碳酸钠溶液,分液得到有机层.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”)
(5)产品精制:精制产品的实验装置如图2所示,试分析装置是否合理,不合理(填“合理”或“不合理”),若不合理将如何改进:温度计处在蒸馏烧瓶的支管口处,冷却水应从下口进上口出.(若装置合理,此空不作答).
(6)本实验得到产品的产率为90%.