题目内容
15.下列离子方程式正确的是( )| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| C. | 向FeBr2溶液中通入等物质的量的氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O |
分析 A.反应生成碳酸钙、碳酸钠和水;
B.反应生成苯酚与碳酸氢钠;
C.等物质的量的FeBr2和Cl2反应,亚铁离子优先反应,溴离子部分反应;
D.三价铁离子能够氧化碘离子生成单质碘.
解答 解;A.碳酸氢钠溶液与少量石灰水反应,离子方程式:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O,故A错误;
B.苯酚钠溶液中通入少量CO2,离子方程式:CO2+H2O+C6H5O-→C6H5OH+HCO3-,故B错误;
C.向FeBr2溶液中通入等物质的量的氯气,离子方程式:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故C正确;
D.氢氧化铁溶于氢碘酸中的离子反应为:2I-+2Fe(OH)3+6H+═2Fe2++6H2O+I2,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.设NA阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,16g由O2和O3组成的混合气体所含电子数8NA | |
| B. | 实验室分别用KClO3和H2O2制取3.2gO2时,转移的电子数均为0.4NA | |
| C. | 25℃时,1L PH=1的稀硫酸中约2NA个H+ | |
| D. | 标准状况下,22.4L SO3所含分子数NA |
10.在V mL的Na2SO4溶液中含a g Na+,则该溶液中SO42-的物质的量浓度为( )
| A. | $\frac{500a}{23V}$mol/L | B. | $\frac{142a}{46V}$mol/L | C. | $\frac{142a}{23V}$mol/L | D. | $\frac{1000a}{23V}$mol/L |
1.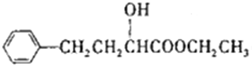 (2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:
(2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:
已知:
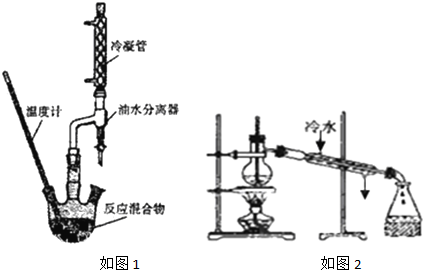
实验装置:
实验步骤:
①按如图1装置连接仪器
②将18.00g 2-羟基-4-苯基丁酸加入三颈瓶中,加入20mL无水乙醇和适量浓硫酸,再加入几块沸石.
③加热至70℃左右保持恒温半小时.
④分离、提纯三颈瓶中粗产品,得到有机产品.
⑤精制产品,得到产品18.72g.
请回答下列问题:
(1)写出制备反应的化学方程式: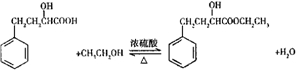 .
.
(2)加入原料时,能否最先加入浓硫酸?否.油水分离器的作用是及时分离产物水,促进平衡向生成酯的反应方向移动.
(3)本实验的加热方式宜用水浴加热.如果温度过高,或浓硫酸的量过多,制备产率会减小(填“增大”、“减小”或“不变”).
(4)分离提纯产品:取三颈瓶中混合物加入足量的饱和碳酸钠溶液,分液得到有机层.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”)
(5)产品精制:精制产品的实验装置如图2所示,试分析装置是否合理,不合理(填“合理”或“不合理”),若不合理将如何改进:温度计处在蒸馏烧瓶的支管口处,冷却水应从下口进上口出.(若装置合理,此空不作答).
(6)本实验得到产品的产率为90%.
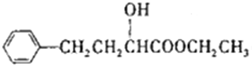 (2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:
(2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:已知:
| 乙醇 | 2-羟基-4-苯基丁酸 | 2-羟基-4-苯基丁酸乙酯 | |
| 相对分子质量 | 46 | 180 | 208 |
| 状态 | 无色液体 | 白色固体 | 无色液体 |
| 沸点/℃ | 78.4 | 356.9 | 212 |
| 密度/g/cm3 | 0.789 | 1.219 | 1.075 |
| 溶解性 | 易溶于水、有机溶剂 | 能溶于水,易溶于有机溶剂 | 难溶于水,易溶于有机溶剂 |

实验步骤:
①按如图1装置连接仪器
②将18.00g 2-羟基-4-苯基丁酸加入三颈瓶中,加入20mL无水乙醇和适量浓硫酸,再加入几块沸石.
③加热至70℃左右保持恒温半小时.
④分离、提纯三颈瓶中粗产品,得到有机产品.
⑤精制产品,得到产品18.72g.
请回答下列问题:
(1)写出制备反应的化学方程式:
 .
.(2)加入原料时,能否最先加入浓硫酸?否.油水分离器的作用是及时分离产物水,促进平衡向生成酯的反应方向移动.
(3)本实验的加热方式宜用水浴加热.如果温度过高,或浓硫酸的量过多,制备产率会减小(填“增大”、“减小”或“不变”).
(4)分离提纯产品:取三颈瓶中混合物加入足量的饱和碳酸钠溶液,分液得到有机层.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”)
(5)产品精制:精制产品的实验装置如图2所示,试分析装置是否合理,不合理(填“合理”或“不合理”),若不合理将如何改进:温度计处在蒸馏烧瓶的支管口处,冷却水应从下口进上口出.(若装置合理,此空不作答).
(6)本实验得到产品的产率为90%.
5.某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:4 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
6.关于吸热反应和放热反应,下列说法中错误的是( )
| A. | A、需要加热才能进行的化学反应一定是吸热反应 | |
| B. | 化学反应中的能量变化除了热量外还可以是光能、电能等 | |
| C. | 化学反应过程中的能量变化服从能量守恒定律 | |
| D. | 生成物的总能量小于反应物的总能量时发生的是放热反应 |
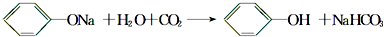 .
.