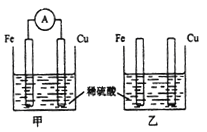
题目内容
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O===O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=_______________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是______________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
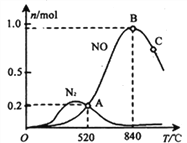
①该催化剂在高温时选择反应_____________(填“ I ”或“ II”)。
②520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=________(不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=________(不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3:Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性(填“SO2”或NH3”),此时溶液c(NH4+)_______c(SO32-)(填“>”“<”或“=”)
【答案】 △H=―1260kJ·molˉ1 A I ![]() E 碱 SO2 >
E 碱 SO2 >
【解析】(1)△H=E(反应物)E(生成物)=(4×391×3+3×4962×9426×463×2)kJmol-1= 1260 kJmol-1。
(2)A项,使用催化剂,改变反应机理,降低活化能,加快反应速率,故A正确;B项,用不同物质表示的反应速率之比=化学计量数之比,所以6v正(NH3)= 4v逆(H2O)时,反应达平衡,故B错误;C项, ![]() =1时,不能说明反应物和生成物的量不再变化,不能说明反应已达平衡,故C错误。综上,选A。
=1时,不能说明反应物和生成物的量不再变化,不能说明反应已达平衡,故C错误。综上,选A。
(3)由已知,结合图像可得,①高温时主要发生反应I。

平衡时,c(NH3)=(10.20.4)mol·Lˉ1=0.4mol·Lˉ1,c(O2)=(20.30.25)mol·Lˉ1=1.45mol·Lˉ1,c(NO)=0.2mol·Lˉ1,c(H2O)=(0.3+0.6)mol·Lˉ1=0.9mol·Lˉ1,所以520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=
4NO(g) +6H2O(g)的平衡常数K=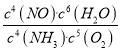 =
=![]() 。
。
③使用催化剂只能改变化学反应速率,不能改变化学平衡,故A、B错误;C项,增大NH3和O2的初始投料比,提高了O2的转化率,降低了NH3的转化率,故C错误;D项,增大反应物浓度,平衡向气体分子数减小方向移动,降低了NH3的转化率,故D错误;E项,对于放热反应,降低温度,平衡右移,提高了NH3的转化率,故E正确。
(4)①由已知可得:Kh(NH4+)=![]() =
=![]() =
=![]() ,Kh(HSO3-)=
,Kh(HSO3-)=![]() =
=![]() =
=![]() ,Kh(SO32-)=
,Kh(SO32-)=![]() =
=![]() =
=![]() ,所以水解常数:Kh(SO32-)>Kh(NH4+)>Kh(HSO3-),故亚硫酸铵溶液水解呈碱性,亚硫酸氢铵溶液水解呈酸性。
,所以水解常数:Kh(SO32-)>Kh(NH4+)>Kh(HSO3-),故亚硫酸铵溶液水解呈碱性,亚硫酸氢铵溶液水解呈酸性。
②因为亚硫酸铵溶液水解呈碱性,所以通入SO2气体可使溶液呈中性;由离子守恒:c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),又因为c(H+)=c(OH-),所以c(NH4+)=2c(SO32-)+c(HSO3-),故c(NH4+)>2c(SO32-)。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案