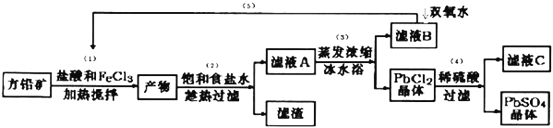
题目内容
【题目】A、B、C是三种金属,根据下列 ①、② 两个实验:① 将A与B浸在稀硫酸中用导线相连,A表面有气泡逸出,B逐渐溶解;② 电解物质的量浓度相同的A、C混合盐溶液时,阴极上先析出C(使用惰性电极)。A、B、C的还原性强弱顺序为( )
A. A>B>CB. B>C>AC. C>A>BD. B>A>C
【答案】D
【解析】
①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解,说明原电池中B做负极,A做正极,金属性B>A;
②电解物质的量浓度相同的A、C混合盐溶液时,阴极上先析出C(使用惰性电极),说明金属性A>C,则A、B、C的还原性强弱顺序为B>A>C,
答案选D。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
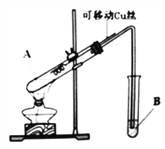
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O===O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=_______________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是______________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
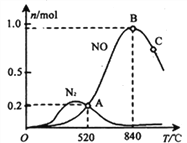
①该催化剂在高温时选择反应_____________(填“ I ”或“ II”)。
②520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=________(不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=________(不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3:Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性(填“SO2”或NH3”),此时溶液c(NH4+)_______c(SO32-)(填“>”“<”或“=”)